
分析 根据质量守恒定律,固体质量减少的质量为二氧化碳的质量,根据反应的化学方程式可以列式计算出碳酸钙的质量;
解答 解:根据质量守恒定律,固体质量减少的质量为二氧化碳的质量,为50t-30t=20t
设可制的二氧化碳的质量为x.
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 44
x 20t
$\frac{100}{x}=\frac{44}{20t}$
x≈45t
石灰石的纯度=$\frac{45t}{50t}×$100%=90%
石灰石中杂质质量=50t-45t=5t
生石灰的纯度=$\frac{30t-5t}{30t}×$100%≈83.3%
答案:石灰石的纯度为90%;生石灰的纯度为83.3%
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 大力开发新能源以替代不可再生的化石燃料 | |
| B. | 普通玻璃是一种纯净物 | |
| C. | 人体因碘摄入量不足,容易导致骨质疏松症 | |
| D. | 为了增加草木灰肥料,大力提倡在田间焚烧秸秆 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用煤炭做燃料放出大量烟气 | B. | 生活污水排入大运河 | ||
| C. | 工业废水排入长江 | D. | 农业上大量使用化肥 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ④ | B. | ②④ | C. | ①③ | D. | ①② |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
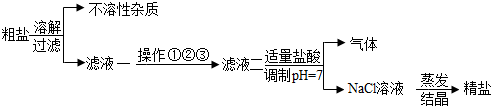
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com