
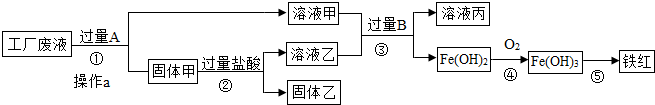
分析 向废水中加入过量的铁,可以把铜还原出来,过滤得到铜、铁.再向固体中加入过量的盐酸,可以把铁除去.这时的固体中只含有铜;溶液甲中含有溶质氯化亚铁和氯化钠,溶液乙中含有氯化亚铁和盐酸向其加入过量的B,氯化亚铁全部和氢氧化钠反应生成氢氧化亚铁沉淀.
解答 解:废液中含有氯化钠、氯化铜和氯化亚铁,由于目的是获得铜和铁红,所以需要在过程中铜离子转化为铜单质,根据流程可以看成铜应该出现在固体甲中,所以A就是转化铜离子用的铁粉,为使铜离子彻底转化,所以应该加入过量的铁粉.这样导致固体甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉,溶液乙为生成的氯化亚铁和剩余的盐酸.而溶液甲为氯化钠和氯化亚铁.溶液甲和乙加入过量的B后生成氢氧化亚铁,说明B为氢氧化钠等可溶性碱.
(1)过滤可以除去不溶于水的物质,玻璃棒起引流作用.故填:引流.
(2)加入过量的A是铁与氯化铜反应,故填:Fe+CuCl2=FeCl2+Cu;
(3)溶液甲中含有溶质氯化亚铁和不参加反应的氯化钠;故填Na+、Fe2+
(4)步骤①②③中①是铁和氯化铜反应;②是铁和盐酸反应;③中发生两个反应;氯化亚铁和氢氧化钠反应;盐酸和氢氧化钠反应这两个反应都属于复分解反应,①②中金属与酸、金属与盐的反应都是置换反应;故填①②
(5)铁红(主要成分Fe2O3),所以判定出反应物是氧化铁和一氧化碳,根据所学知识生成物应是铁和二氧化碳;故填3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
点评 本题主要考查了玻璃棒的作用:(溶解中其加速溶解的作用、过滤中起引流的作用、蒸发中起使其受热均匀地作用);书写化学方程式的配平,判断某种物质是否过量等方面的内容.


科目:初中化学 来源: 题型:填空题
 2011年3月11日13时45分,日本发生9级地震.
2011年3月11日13时45分,日本发生9级地震.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
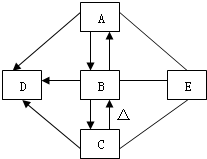 如图A、B、C、D、E是初中化学中常见的五种物质,且A、B、C、D都含有一种相同的元素.其中C俗称小苏打,D为食盐的主要成分,A、E发生中和反应,图中“--”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系;部分反应物或生成物已略去.根据图示关系及所给条件完成下列各空:
如图A、B、C、D、E是初中化学中常见的五种物质,且A、B、C、D都含有一种相同的元素.其中C俗称小苏打,D为食盐的主要成分,A、E发生中和反应,图中“--”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系;部分反应物或生成物已略去.根据图示关系及所给条件完成下列各空:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在公共场所有如下一则广告,请你分析是否科学.
在公共场所有如下一则广告,请你分析是否科学. 查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 氢氧化钙溶液 | 有白色沉淀生成 | 猜想②正确. 相关的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | ①中的铁钉底部生锈最严重 | |
| B. | ②中的蒸馏水煮沸的目的是除去水中的溶氧 | |
| C. | ②中的植物油是为了隔绝空气 | |
| D. | ①②③对比可探究铁的锈蚀至少与氧气和水有关 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com