某同学用下列实验测定一种暴露在空气中的干燥的烧碱样品的纯度.
①称取5.06克烧碱样品配成溶液,加入酚酞试液显红色;
②逐滴加入过量H2SO4溶液后,收集到0.44克二氧化碳气体.
求:(1)烧碱样品中的NaOH质量分数是多少?
(2)实验②中溶液由红色变为无色(呈中性)时,消耗H2SO4溶液24.0克.则H2SO4溶液中H2SO4的质量分数是多少?
解:(1)设烧碱样品中Na
2CO
3的质量为X
H
2 SO
4+Na
2CO
3═Na
2SO
4+H
2O+CO
2↑
106 44
x 0.44g
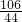
═
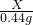
x═1.06g
烧碱样品中的NaOH质量分数为:(5.06g-1.06g)÷5.06g×100%═79.05%
(2)设与Na
2CO
3反应的H
2 SO
4 质量为y,与NaOH 反应的H
2 SO
4 的质量为z
H
2 SO
4+Na
2CO
3═Na
2SO
4+H
2O+CO
2↑
98 44
y 0.44g

═
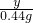
y═0.98g
H
2 SO
4+2NaOH═Na
2 SO
4+2H
2O
98 80
z 5.06g-1.06g=4g

═

z═4.9g
(0.98g+4.9g)÷24.0g×100%═24.5%
答:(1)烧碱样品中的NaOH质量分数是79.05%.
(2) 则H
2SO
4溶液中H
2SO
4的质量分数是24.5%.
分析:(1)根据收集到0.44克二氧化碳气体的质量可以求出碳酸钠的质量.再根据碳酸钠的质量可以求出样品中烧碱的质量,进而求出烧碱样品中的NaOH的质量分数.
(2)根据碳酸钠的质量和烧碱的质量以及方程式求出硫酸的质量,再由溶质质量分数的计算式求出H
2SO
4溶液中H
2SO
4的质量分数.
点评:此题属于多步计算题,需正确写出方程式,再准确找出各物质之间的质量关系,才可以解出.此类题由于步骤繁琐,在中考中已不多见.

 ═
═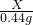
 ═
═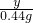
 ═
═


 轻松暑假总复习系列答案
轻松暑假总复习系列答案