
| A. | 向某固体中加入稀盐酸,产生气体,则该固体一定是碳酸盐 | |
| B. | 置换反应中一定会发生元素化合价的改变 | |
| C. | 把CuSO4、HNO3、BaCl2同时加到水中,能得到无色透明的溶液 | |
| D. | 某溶液中加入BaCl2溶液,产生白色沉淀,则该溶液中肯定含有SO42- |
分析 向某固体中加入稀盐酸,产生气体,则该固体不一定是碳酸盐;
一种单质和一种化合物反应生成另一种单质和另一种化合物的反应是置换反应;
溶液中的铜离子显蓝色;
某溶液中加入BaCl2溶液,产生白色沉淀,则该溶液中不一定含有硫酸根离子.
解答 解:A、向某固体中加入稀盐酸,产生气体,则该固体不一定是碳酸盐,例如锌和稀盐酸反应生成氢气,该选项说法不正确;
B、一种单质和一种化合物反应生成另一种单质和另一种化合物的反应是置换反应,因此置换反应中一定会发生元素化合价的改变,该选项说法正确;
C、溶液中的铜离子显蓝色,硫酸铜和氯化钡反应生成硫酸钡沉淀和氯化铜,溶液仍然是蓝色的,该选项说法不正确;
D、某溶液中加入BaCl2溶液,产生白色沉淀,则该溶液中不一定含有硫酸根离子,例如溶液中含有银离子时,能和氯离子结合成氯化银沉淀,该选项说法不正确.
故选:B.
点评 本题主要考查物质的性质,只有掌握了各种物质的性质,才能够判断物质之间相互转化时的反应物和生成物,从而可以进行各方面的判断.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:初中化学 来源: 题型:填空题
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有CO2 | CO和CO2都有 |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
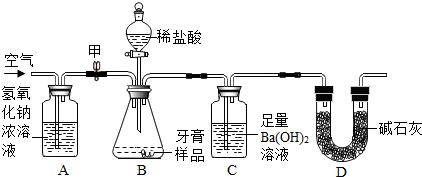
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A.对除杂和鉴别的认识 | B.对生活常识的认识 |
| ①用Ca(OH)2溶液除去NaOH中少量的Na2CO3 ②用熟石灰鉴别硫酸铵和硫酸钾 ③用肥皂水鉴别硬水和软水 | ①煤炉上放一壶水可以预防CO中毒 ②液化气泄漏时应立即关闭阀门并开窗通风 ③用水灭火的原理是降低可燃物的着火点 |
| C.对性质与用途的认识 | D.对概念的理解 |
| ①因活性炭具有强吸附性可用来吸附毒气 ②因氧气具有可燃性可用于炼钢 ③因稀有气体通电时发出有色的光可制成各种电光源 | ①能改变反应速率的物质一定是催化剂 ②氧化反应一定是物质与氧气发生的反应 ③合金比组成它的纯金属强度和硬度更高、抗腐蚀性能更好 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
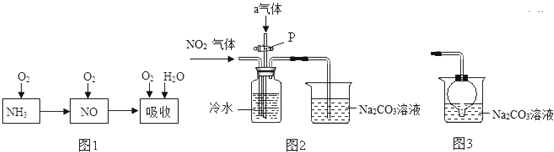
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
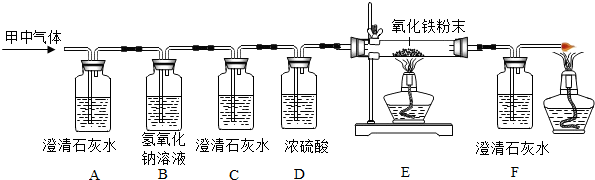
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 物质的性质和用途是化学的重要研究内容.
物质的性质和用途是化学的重要研究内容.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com