
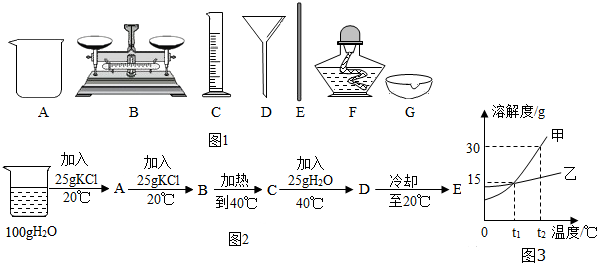
分析 (1)从生理盐水中有氯化钠和水去分析解答;
(2)从配制500g生理盐水的步骤及每一步需要的仪器去分析解答;
(3)从饱和溶液和不饱和溶液中溶质与溶剂的关系去分析解答;
(4)根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)生理盐水中有氯化钠和水,其中氯化钠是固体,水是液体,所以氯化钠是溶质;
故答案为:NaCl;
(2)配制500g生理盐水,需要用托盘天平称量500g×0.9%=4.5g的食盐,和用量筒量取495.5ml的水,并把食盐和水放在烧杯里溶解,并作玻璃棒进行搅拌;故答案为:ABCE;若量取水时,仰视读数,所取水的体积变大,则所配溶液的溶质质量分数偏小;
(3)①已知KCl的溶解度20℃时为34g.其含义为:在20℃时在100g水里,最多能溶解34g氯化钾;
在A中,由于氯化钾的质量25g<34g,此时所得溶液为不饱和溶液,溶质的质量为:$\frac{25g}{100g+25g}$×100%=20%;
在B中,溶质质量为25g+25g=50g,但在20℃在100g水里,最多能溶解34g氯化钾,此时溶质有剩余:50g-34g=16g,因此溶液中的溶质与溶剂的质量比为:34g:100g=17:50;溶质的质量分数为:$\frac{34g}{100g+34g}$
×100%=25.4%;
在C中在40℃时,此时由于氯化钾的溶解度为40g,C中的溶质仍有剩余(50g-40g=10g);溶质的质量分数为:$\frac{40g}{100g+40g}$×100%=28.6%;
在D中设125g水中最多溶解氯化钾的质量为X,
40g/100g=X/125g;解之得:X=50g;故此时溶液恰好饱和;
溶质的质量分数为:$\frac{50g}{50g+125g}$×100%=28.6%
在E中当冷却到20℃时,100g水中最多可溶解34氯化钾,由于溶液具有均一性,所以125g水中最多可溶解42.5g,此时为饱和溶液,故溶质的质量分数为:$\frac{42.5g}{100g+42.5g}$×100%=25.4%;
②由上面①的分析可知答案为:D; B与E和C与D.
(4)A、甲的溶解度大于乙的溶解度错误,因为没有指明温度;故选项错误;
B、t1℃时,甲、乙两物质的溶解度为15g,饱和溶液中溶质的质量分数均为$\frac{15g}{100g+15g}$×100%≈13%,故选项错误;
C、将乙的不饱和溶液变成饱和溶液,可采用加溶质、降温、蒸发溶剂的方法等,故选项正确;
D、t2℃时,甲的溶解度为30g,将50g甲物质放入100g水中,得到溶液的质量为130g,故选项错误.
答案:
(1)NaCl;
(2)ABCE;小;
(3)①17:50;②D;B与E和C与D.
(4)C.
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.计算溶质质量分数时剩余的溶质不能参与计算.


科目:初中化学 来源: 题型:解答题
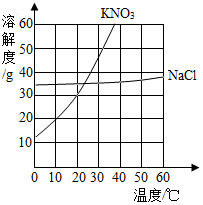 根据图中KNO3和NaCl的溶解度曲线,回答问题.
根据图中KNO3和NaCl的溶解度曲线,回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | Na2SO4(NaOH) | 稀硫酸 | 加过量的稀硫酸、蒸发结晶 |
| B | NaCl (Na2CO3) | 稀盐酸 | 加过量的稀盐酸、蒸发结晶 |
| C | KCl(KClO3) | MnO2 | 加MnO2,加热后冷却 |
| D | CO(CO2) | 烧碱溶液 浓硫酸 | 将混合气体先通过足量的烧碱溶液的洗气瓶,再通过浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com