解:(1)A、由于所取药品是微量,如果先在两托盘上各放一张质量相同的纸,会使误差加大,实验数据不准确.故A不适合;
B、用200mL的量筒量取54mL的水,需要量取三次,在倾倒的过程中容易有损耗.故B不适合;
C、将称取的6gNaOH加入盛有54mL水的量筒中,容易使水溅出,应该先放入氢氧化钠固体,在徐徐加入水,搅拌溶解.故C不适合;
D、变质的氢氧化钠就是碳酸钠,由于变质后氢氧化钠的质量减少,故用变质的氢氧化钠6g与54mL水配制成的溶液,NaOH的质量分数偏低.故D适合.
故选D.
(2)2NaCl+2H
2O

2NaOH+Cl
2↑+H
2↑
(3)①烧碱变质是NaOH与空气中的二氧化碳反应生成碳酸钠和水.反应的化学方程式为:2NaOH+CO
2=Na
2CO
3+H
2O;
②可选择澄清的石灰水除去变质的成分,化学方程式为:Na
2CO
3+Ca(OH)
2=2NaOH+CaCO
3↓;
(4)解:设样品中碳酸钠的质量为x,
生成二氧化碳的质量为10g+50g+64.4g-122.2g=2.2g,
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 44
x 2.2g
∴
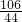
=
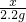
,
解之得:x=5.3g;
样品中氢氧化钠的质量为10g-5.3g=4.7g,
样品中氢氧化钠的质量分数为:

×100%=47%.
答:样品中氢氧化钠的质量分数为47%.
分析:(1)根据实验要求逐一分析,即可正确选择;
(2)根据已知条件可知,电解饱和NaCl溶液,生成烧碱、氢气和氯气,据此写出化学方程式即可;
(3)①烧碱变质是NaOH与空气中的二氧化碳反应生成碳酸钠和水.据此写出化学方程式即可;
②因为氢氧化钙与碳酸钠反应生成碳酸钙沉淀,过滤即可去除;
(4)根据碳酸钠与盐酸反应的化学方程式和二氧化碳的质量,列出比例式,就可计算出样品中碳酸钠的质量,进而计算出样品中氢氧化钠的质量,然后根据质量分数公式计算即可.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑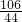 =
=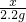 ,
, ×100%=47%.
×100%=47%.

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
