
| 方案一 | 方案二(数字化实验) |
 |  |
| 方案一 | 方案二(数字化实验) |
 |  |
| 方案一 | 方案二(数字化实验) |
 |  |
分析 ①根据二氧化碳与水化合生成了碳酸分析回答;
②根据溶液的酸碱度与酸碱性的关系分析;
③根据蜡烛燃烧生成物的性质分析回答;
④根据蜡烛燃烧的生成物分析;
⑤根据碳酸钙与稀盐酸的反应写出反应的化学方程,根据固定变量法探究物质性质的方法分析盐酸的浓度;
⑥根据相同时间内产生气体的多少分析.
解答 解:①由于二氧化碳与水化合生成了碳酸,所以图1中可观察到甲试管中的紫色液体变为红色,发生反应的化学方程式是:CO2+H2O=H2CO3,乙试管的作用是与试管A起对照作用;
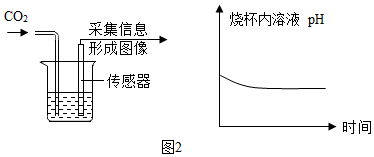
②由图2坐标图中的曲线可知,溶液的pH逐渐变小,说明了烧杯内溶液的酸性逐渐变强.
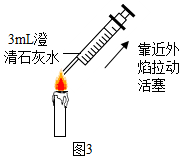
③由于二氧化碳能与氢氧化钙反应生成了碳酸钙和水,如图3所示,用注射器在蜡烛外焰部位抽气并振荡,可观察到石灰水变浑浊,证明反应生成了二氧化碳;若将干冷的烧杯罩在火焰上方,观察到烧杯内壁有水雾,证明反应生成了水.
④如图4所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如坐标图所示,由于蜡烛燃烧消耗了氧气,生成了二氧化碳和水,曲线b、c能够说明蜡烛燃烧生成了二氧化碳和水.
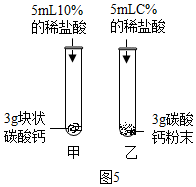
⑤碳酸钙与稀盐酸发生反应的化学方程式是:CaCO3+2HCl→CaCl2+H2O+CO2↑;要比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度,盐酸的浓度应相同,所以图5中,乙试管中稀盐酸的浓度C%应为10%;较之块状碳酸钙,碳酸钙粉末与稀盐酸的反应更为剧烈,原因是:反应物之间的接触面积更大.
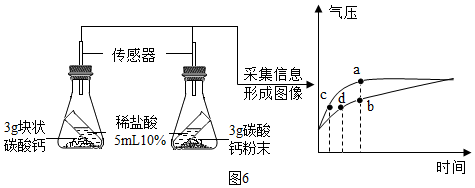
⑥按图6所示进行实验,倾斜锥形瓶使小试管内的稀盐酸流入瓶中与固体接触发生反应,瓶内气压的变化如坐标图所示.对比分析坐标图中的点c、d可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短.
故答为:①红;CO2+H2O=H2CO3,对照;
②强;
③石灰水变浑浊,烧杯内壁有水雾;
④b、c;
⑤CaCO3+2HCl→CaCl2+H2O+CO2↑;10%;反应物之间的接触面积更大;
⑥c、d.
点评 本题通过“数字化实验”探究了物质的性质,本题看似难度很大,实际上考查了物质的基本性质,了解物质的性质和一些量之间的变化是解答本题的基础知识.


科目:初中化学 来源: 题型:选择题

| A. | 反应中钠原子转移一个电子给氯原子 | |
| B. | 钠离子与钠原子有相似的化学性质 | |
| C. | 核外电子在化学反应中起着重要作用 | |
| D. | 氯化钠由氯离子和钠离子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 甲、乙同学在学完酸的化学性质后,做了如图所示实验:实验结束后,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论.
甲、乙同学在学完酸的化学性质后,做了如图所示实验:实验结束后,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡. | 有气泡冒出. | 氢氧化钠溶液一定变质了. |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. | 有生成. | 说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变红色. | 说明原溶液中一定有. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 老师用如图所示装置为同学们做如下实验:A装置集气瓶中装有体积比约为1:1的氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量生锈的铁钉;D装置中盛有足量的稀硫酸.
老师用如图所示装置为同学们做如下实验:A装置集气瓶中装有体积比约为1:1的氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量生锈的铁钉;D装置中盛有足量的稀硫酸.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com