
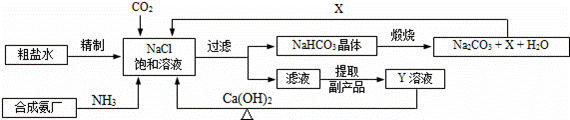
我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如下:
| 部分物质溶解性(室温) |
| ||
| OH﹣ | SO42﹣ | CO32﹣ | |
| Mg2+ | 不 | 溶 | 微 |
| Ca2+ | 微 | 微 | 不 |
| Ba2+ | 溶 | 不 | 不 |
(1)粗盐水中主要含有Ca2+、Mg2+、SO42﹣等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制.则加入试剂合理的顺序为 、盐酸(只写一种).加盐酸的作用是(用化学方程式表示) 、 .
(2)制碱原理为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,该反应原理可看作是由:①CO2+NH3+H2O=NH4HCO3和
②NaCl+NH4HCO3=NaHCO3↓+NH4Cl两个反应加合而成,则的反应类型为 .
(3)X的化学式为 .
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为 ,Y的化学式为 ,写出Y的一种用途 .
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:

| 部分物质溶解性(室温) | |||
| OH- | SO42- | CO32- | |
| Mg2+ | 不 | 溶 | 微 |
| Ca2+ | 微 | 微 | 不 |
| Ba2+ | 溶 | 不 | 不 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com