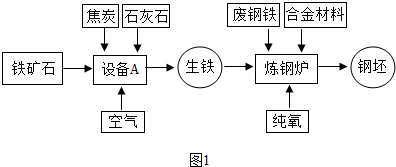
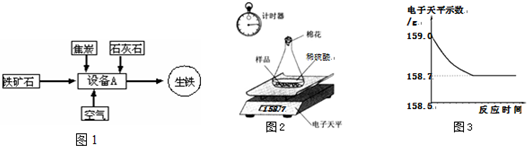
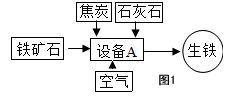
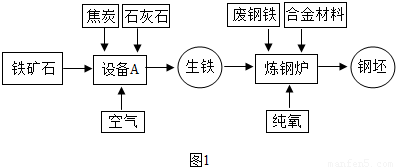
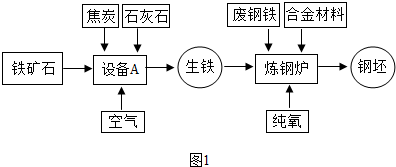
解:(1)工业炼铁所使用的设备为高炉,炼铁过程是在高炉内完成的;
故答案为:高炉;
(2)赤铁矿中的氧化铁在高温下与一氧化碳发生氧化还原反应,生成单质铁和气体二氧化碳;
故答案为:3CO+Fe
2O
3
2Fe+3CO
2;
(3)石灰石的主要成分碳酸钙在高温锻烧时分解生成氧化钙和二氧化碳;
故答案为:CaCO
3
CaO十CO
2↑;
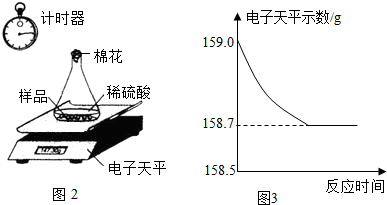
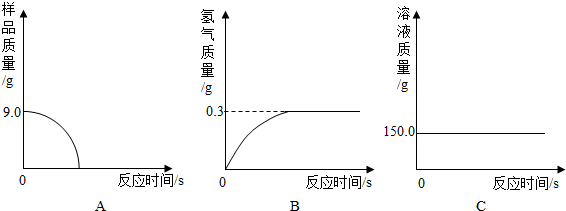
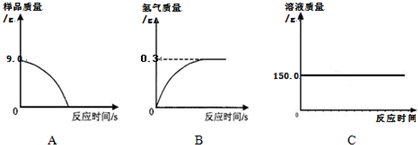
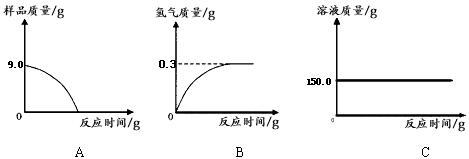
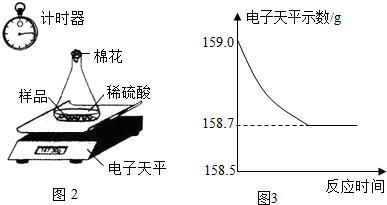
(4)①由于生铁样品中的杂质不溶于水且不与酸发生反应,因此反应停止后样品的质量不为0;所以图A所示的分析错误;
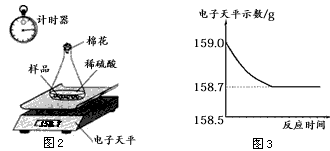
随着生铁不断与稀硫酸反应,放出氢气质量逐渐增大,至完全反应,放出氢气的质量=159.0g-158.7g=0.3g;所以图B的分析正确;
加入稀硫酸的质量=159.0g-44.1g-9.0g=105.9g,反应使溶液的质量逐渐增大,直到反应停止溶液质量不再改变;所以图C的分析错误;
故答案为:B;
②③设反应的铁的质量为x,生成的硫酸亚铁的质量为y
Fe+H
2SO
4═FeSO
4+H
2↑
56 152 2
x y 0.3g
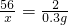
解得 x=8.4g
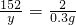
解得 y=22.8g
铁的质量分数=
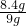
×100%=93.3%
硫酸亚铁的溶质质量分数=
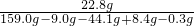
×100%=20%
答:样品中铁的质量分数为93.3%,硫酸亚铁的溶质质量分数为20%.
分析:(1)工业炼铁又称为高炉炼铁,因为工业炼铁使用的设备为高炉;
(2)赤铁矿石中的氧化铁在高温下与一氧化碳反应,生成铁和二氧化碳;
(3)碳酸钙高温锻烧可分解生成氧化钙和二氧化碳;
(4)根据反应记录数据,完全反应放出氢气质量=159.0g-158.7g=0.3g,加入稀硫酸的质量=159.0g-44.1g-9.0g=105.9g;结合反应的化学方程式,由生成氢气的质量计算生铁中铁的质量、反应生成硫酸亚铁的质量等,完成分析和计算.
点评:根据质量守恒定律,反应后所得溶液的质量=所加稀盐酸的质量+参加反应铁的质量-放出氢气的质量.


 2Fe+3CO2;
2Fe+3CO2; CaO十CO2↑;
CaO十CO2↑;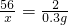 解得 x=8.4g
解得 x=8.4g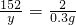 解得 y=22.8g
解得 y=22.8g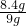 ×100%=93.3%
×100%=93.3%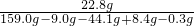 ×100%=20%
×100%=20%

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案