
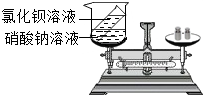
 小章同学设计了如图所示的实验来验证质量守恒定律,在实验前左盘总质量为m,将试管中的溶液倒入烧杯后,左盘总质量为m,小章同学认为实验成功,你认为该实验设计合理吗?为什么?
小章同学设计了如图所示的实验来验证质量守恒定律,在实验前左盘总质量为m,将试管中的溶液倒入烧杯后,左盘总质量为m,小章同学认为实验成功,你认为该实验设计合理吗?为什么?  阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:初中化学 来源: 题型:填空题
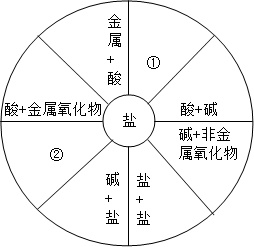 小梅同学学习了单质、氧化物、酸、碱、盐的性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了如图所示的知识网络图.借助网络图回答:
小梅同学学习了单质、氧化物、酸、碱、盐的性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了如图所示的知识网络图.借助网络图回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
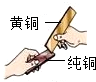 金属材料在生产、生活中应用广泛.
金属材料在生产、生活中应用广泛.| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g•cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 上述反应共涉及三种氧化物 | |
| B. | 尿素含氮量高,是一种很好的氮肥 | |
| C. | C、H、0、N四种元素均位于周期表第二周期 | |
| D. | 尿素中含有CO分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| NaHCO3 | Na2CO3 | |
| 加人稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加人饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加人CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加人过量 的CaCl2溶液. | 有白色沉淀产生 | 该反应的方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液. | 有气泡冒出 | 证明猜想②成立. |
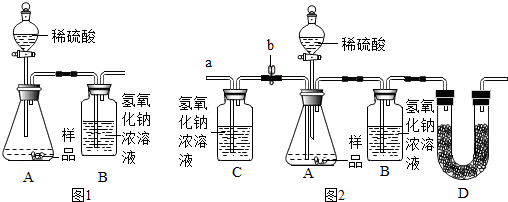
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
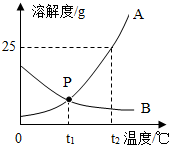 海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔.
海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔.
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 马蹄飞燕为东汉青铜器,1969年出土于甘肃省武威雷台的东汉墓,现藏于甘肃省博物馆,1983年10月,马蹄飞燕被国家旅游局确定为中国旅游标志,1986年被定为国宝级文物.
马蹄飞燕为东汉青铜器,1969年出土于甘肃省武威雷台的东汉墓,现藏于甘肃省博物馆,1983年10月,马蹄飞燕被国家旅游局确定为中国旅游标志,1986年被定为国宝级文物.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论及反应方程式 |
| 向滴有酚酞溶液的稀氢氧化钠溶液的试管中,加入稀硫酸,并振荡 | 观察到溶液由红色变为无色 | 氢氧化钠和硫酸发生了反应,反应的化学方程式为H2SO4+2NaOH═Na2SO4+2H2O |
| 实验步骤 | 预期实验现象 | 实验结论 |
| 取(1)实验后溶液少量于试管中,加入锌粒 | 有气泡产生 (或没有气泡产生) | 猜想三(或一)正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
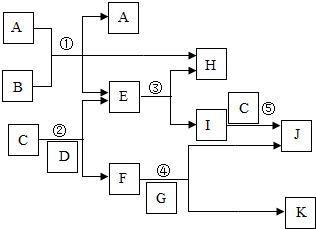 A-K都是初中化学中常见的物质,它们之间的一些转化关系如图(部分费用的条件和产物已经略去).A、C是黑色的固态氧化物,B、E是液态氧化物,F的溶液呈蓝色,F的金属元素的质量分数为40%,K的溶液呈浅绿色.请回答:
A-K都是初中化学中常见的物质,它们之间的一些转化关系如图(部分费用的条件和产物已经略去).A、C是黑色的固态氧化物,B、E是液态氧化物,F的溶液呈蓝色,F的金属元素的质量分数为40%,K的溶液呈浅绿色.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com