
【题目】工业上以白云石(主要成分为CaCO3和MgCO3)为原料制备氢氧化镁的流程如图所示,请回答以下问题:

资料卡片:
①轻烧时温度低于700 °C;
②![]() ;
;
③![]() ;
;
④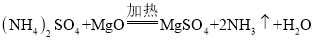
(1)白云石轻烧后所得固体的主要成分是__________。
(2)流程中研磨的目的是____________。
(3)流程中除水以外可以循环利用的物质是________。
(4)流程中最后一个步骤是向硫酸镁溶液中通入氨气,反应生成氢氧化镁沉淀和硫酸铵,该反应的化学方程式是_________。
(5)如果轻烧时温度超过700 °C ,对流程产生的影响是____________。
【答案】CaCO3和MgO 增大反应物之间的接触面积,加快反应 (NH4)2SO4和NH3 ![]() 温度超过700 °C .碳酸钙发生分解反应生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,影响生成物的纯度
温度超过700 °C .碳酸钙发生分解反应生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,影响生成物的纯度
【解析】
(1)由题意可知,轻烧时的温度低于700 °C,此时白云石中的碳酸镁分解生成氧化镁和二氧化碳,而碳酸钙不发生反应,所以白云石轻烧后所得固体的主要成分是CaCO3和MgO,故填CaCO3和MgO。
(2)研磨可将块状固体研成粉末,增大了固体的表面积,进而增大了反应物之间的接触面积,能够加快反应,故填增大反应物之间的接触面积,加快反应。
(3)由流程图可知,生产过程中,既有硫酸铵和氨气参加的反应,也有生成硫酸铵和氨气的反应,所以流程中除水以外可以循环利用的物质还有(NH4)2SO4和NH3,故填(NH4)2SO4和NH3。
(4)该反应是硫酸镁、水和氨气反应生成氢氧化镁沉淀和硫酸铵,故反应的化学方程式写为MgSO4+2NH3+2H2O=Mg(OH)2↓+(NH4)2SO4。
(5)如果温度超过700 °C ,碳酸钙就会发生分解反应生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,从而影响生成物的纯度,故填温度超过700 °C,碳酸钙发生分解反应生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,影响生成物的纯度。


 字词句段篇系列答案
字词句段篇系列答案科目:初中化学 来源: 题型:
【题目】利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法不正确的是
A.先推入的是NaOH溶液
B.BC段,CO2与NaOH反应基本停止
C.D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多
D.最终压强比初始压强小,可能是因为有部分二氧化碳溶于水
查看答案和解析>>
科目:初中化学 来源: 题型:
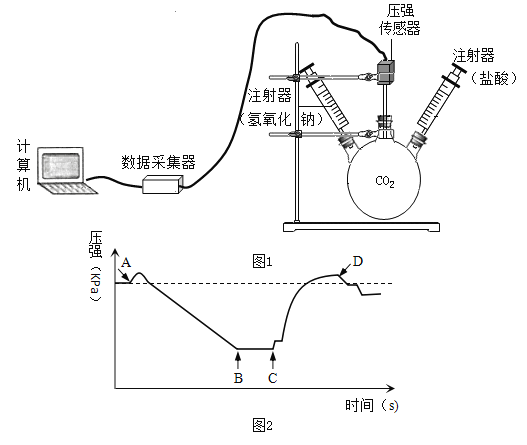
【题目】某学习小组同学欲利用绿色粉末碱式碳酸铜[Cu2(OH)2CO3]制备金属铜,并进行相关的实验。
[实验一]制备氧化铜并检验产物,装置如下图所示(省略夹持仪器)。
步骤一:打开弹簧夹,通入氮气。
步骤二:关闭弹簧夹,将A、B、C装置连接,并开始加热至A中固体质量不变,停止加热。
通入氮气的作用是________________;实验过程中,观察到A中有黑色固体生成,B中无水硫酸铜变蓝色、C中澄清石灰水变浑浊。碱式碳酸铜受热分解除了生成氧化铜,还生成了________________。装置C中反应的化学方程式为________________。
[实验二]用[实验一]中产生的氧化铜制备金属铜。
方法1:用一定量碳粉与[实验一] 中产生的氧化铜加热制取铜并检验产物。

实验过程中,观察到G中溶液变浑浊。E 中试管内固体反应的化学方程式是________________;装置F的作用是_____________________。
实验反思:为何[实验一]中步骤二需要加热至A中固体质量不变,才停止加热。分析可能的原因是____________________。
方法2:取适量[实验一]中产生的氧化铜,依据下列实验流程制取金属铜。

步骤I中反应的化学方程式是________________,观察到的现象是________________;步骤II中滤渣的成分是________________, 在滤渣中加入过量稀硫酸反应化学方程式是________________。
实验反思:在[实验二]中,你认为方法2优于方法1的理由是________________(写一条)。
查看答案和解析>>
科目:初中化学 来源: 题型:
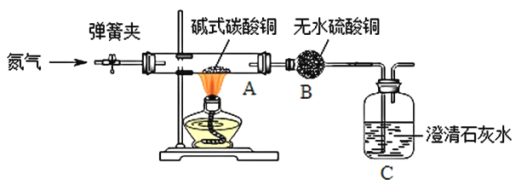
【题目】二氧化碳与氢氧化钠溶液反应没有明显现象,某兴趣小组设计如下图所示的实验装置,欲证明二氧化碳与氢氧化钠发生反应。
实验序号 | 实验操作 | 实验现象 |
① | 启动CO2传感器 | |
② | 将注射器1中的溶液推入充有CO2的瓶中 | 气球胀大 |
③ | 将注射器2中的溶液推入瓶中 | ________ |
(1)实验是从定量的角度验证二氧化碳与氢氧化钠的反应,绘制曲线图象如图所示:
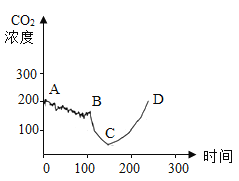
BC段发生反应的化学方程式为_________(假设氢氧化钠过量) ,CD段CO2浓度增大的原因是___________。
(2)实验结束后,向剩余的溶液中滴加酚酞溶液,发现溶液变成红色。同学们对这一现象产生了兴趣。
[提出问题]剩余溶液中,能使溶液呈碱性的物质是什么?
[猜想假设]小亮认为:只有碳酸钠
小红认为:只有氢氧化钠
小华认为:二者可能都有
[查阅资料]①同等条件下,中和反应优于酸和碳酸盐的反应
②氯化钙(或氯化钡)溶液呈中性
[交流讨论]同学们讨论后认为小红和小华的猜想均不成立。理由是__________。
[实验设计]小亮设计了如下实验,通过实验证明自己的猜想是正确的。
实验操作 | 实验现象 | 实验结论 |
①__________ | ________ | 小亮的猜想正确 |
②充分反应后,滴加几滴无色酚酞试液 | 溶液不变色 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶含杂质的氯酸钾。化学小组取这种氯酸钾30g,加入二氧化锰,制取氧气(杂质不参加反应),加热充分反应后,收集到氧气9.6g,冷却后称量剩余固体质量为28.4g,反应的化学方程为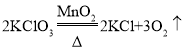
(1)加入二氧化锰的质量为 g。
(2)该氯酸钾的质量分数(写出计算过程,结果精确到 0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示化学反应中溶液的颜色变化.下列叙述错误的是
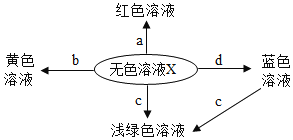
A.若X是稀硫酸,a可能是无色酚酞试液
B.若X是稀硫酸,b可能是氧化物
C.若X是稀盐酸,c不可能是单质
D.若X是稀盐酸,d不可能是单质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(1)测定废水pH的方法是______。
(2)配制200 g质量分数为5.6%的氢氧化钾溶液
①计算:m(KOH)=___g,V(H2O)=______mL(水的密度近似为1.0gmL-1)
②称取氢氧化钾:调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量.然后____(按操作先后顺序,填字母),直至天平平衡。
A 向烧杯中加氢氧化钾固体
B 按需要添加砝码、移动游码
③量取水: ④溶解; ⑤转移。
(3)定量测定废水:取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示。(假设废水中其他成分不与氢氧化钾反应)
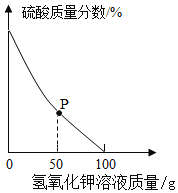
①P点对应溶液中一定存在的阳离子有_____(填离子符号)。
②废水中硫酸的质量分数为______(结果保留到0.1%).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用电解饱和食盐水的方法制备烧碱(NaOH)、氯气(Cl2)和氢气,并以它们为原料生产一系列化工产品,称为氯碱工业,某化学兴趣小组同学在实验室进行如下探究:
探究一:验证电解饱和食盐水的产物
(查阅资料)(1)氯气在通常情况下呈黄绿色、是一种有强烈刺激性气味的有毒气体;(2)氯气能与碱溶液发生反应,能使湿润的淀粉碘化钾试纸变蓝。
(实验验证)按图甲所示装置进行实验探究
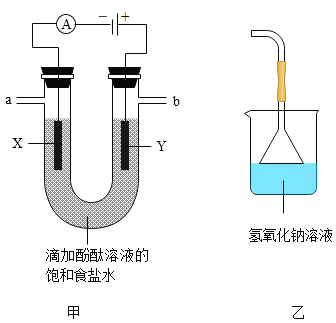
接通电源一段时间后,观察到X、Y电极周围均有气泡产生,溶液由无色变为红色。用小试管在a端收集气体,移近酒精灯火焰,松开拇指,发出轻微的爆鸣声。将湿润的淀粉碘化钾试纸放在b端,试纸变蓝。
(实验分析)
(1)a端收集到的气体是_____。
(2)电解饱和食盐水的化学方程式为_____。
(3)b端后连接乙装置,乙装置中氢氧化钠溶液的作用是_____。
(拓展延伸)上述电解饱和食盐水实验中,电解产物之间能发生化学反应。为避免产物混合发生反应,工业上常用离子交换膜法进行生产制备,将得到的溶液蒸发结晶获得烧碱。
探究二:工业上生产的烧碱中含有哪些杂质?
(猜想假设)
猜想一:NaCl
猜想二:Na2CO3
猜想三:NaCl和Na2CO3
工业上生产的烧碱中可能含有Na2CO3,作出此猜想的依据是_____。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取少量烧碱样品于试管中,加适量水溶解,加入过量的稀硝酸,再滴加少量硝酸银溶液 | _____ | 猜想三正确 |
(反思评价)
(1)小乐同学认为上述实验中可用稀盐酸代替稀硝酸,小娟不同意,小娟的理由是_____,
(2)除去烧碱溶液中少量的碳酸钠,可选用的药品是_____ (填标号)。
A CuCl2溶液
B Ba(NO3)2溶液
C Ba(OH)2溶液
D KOH溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一年前,2019年3月30日,四川凉山发生森林大火,31名消防人员牺牲。一年后,2020年3月30日,本该他们一周年祭的日子,四川凉山西昌再次发生森林大火,火灾过火面积1000余公顷,该起火灾也造成了19名地方扑火人员牺牲。可是,我们并不想他们成为英雄,为了最可爱的人,我们应当学会燃烧与灭火,预防火灾发生。

(1)消防员携带鼓风式森林灭火器(如图)进山灭火,该灭火器通过内置柴油发动机使鼓风机扇片高速转动,喷出十二级强风,这种灭火器的灭火原理是破坏了燃烧三要素中______________________
(2)家庭用火不慎也易导致火灾,若油锅起火,用锅盖盖住的灭火原理是________________
(3)专家分析,造成消防员牺牲的元凶不是大火本身,而是“燃爆”瞬间消耗大量的氧气,产生有毒物质使消防员中毒昏迷死亡,写出其中可能的化学反应方程式__________________
(4)为避免火灾发生,在林场等场所要贴警示标志。下列图标中,表示“禁止放易燃物”的是_____________
A  B
B  C
C  D
D 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com