
 2KCl+3O2↑
2KCl+3O2↑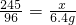 x=16.3g
x=16.3g

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| △ |
| 实验操作 | 实验现象 | 实验结论或总结 | ||
| 各步骤结论 | 总结 | |||
| 实验一 | 将氯酸钾加热至融化,伸入带火星的木条, | 木条复燃 | 氯酸钾受热分解产生氧气,但 放出氧气的速度很慢 放出氧气的速度很慢 . |
二氧化锰是氯酸钾受热分解的催化剂 |
| 实验二 | 加热二氧化锰,伸入带火星的木条, | 木条 不复燃 不复燃 |
加热二氧化锰不能 产生氧气 | |
| 实验三 | 加热氯酸钾和二氧化锰的混合物 加热氯酸钾和二氧化锰的混合物 |
木条迅速 复 燃 |
二氧化锰能加快氯酸钾 的分解 | |
| 加热时间 | T1 | T2 | T3 | T4 |
| 剩余固体质量 | 4.24g | 4.16g | 4.08g | 4.08g |

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com