
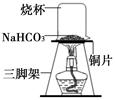
| 实验操作 | 实验现象 | 实验结论 |
| A.将该固体溶于蒸馏水配制成溶液,取少量溶液于试 管中,滴加足量稀盐酸 | 有气体产生 | 假设 (填序号)不成立 |
| B.另取少量溶液于试管中,滴加足量氯化钡溶液 | | 固体产物中有 Na2CO3 |
| C.取上述B步骤静置后所得上层清液,滴入少量酚酞 溶液 | 无明显现象 | 固体产物中 |
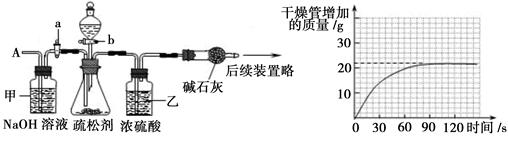
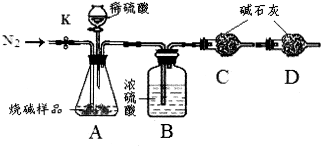
 Na2CO3+CO2↑+H2OⅡ.定量探究 (1)检查装置的气密性 (2)吸收二氧化碳中混有的水蒸气 吸收鼓入空气中的二氧化碳(3)84%
Na2CO3+CO2↑+H2OⅡ.定量探究 (1)检查装置的气密性 (2)吸收二氧化碳中混有的水蒸气 吸收鼓入空气中的二氧化碳(3)84% Na2CO3+CO2↑+H2O;Ⅱ.定量探究(1)步骤①加入样品前还应检查装置的气密性,(2)因为装置乙中试剂为浓硫酸,故其作用是吸收二氧化碳中混有的水蒸气,实验步骤③中,甲装置的作用是吸收鼓入空气中的二氧化碳,防止出现较大误差
Na2CO3+CO2↑+H2O;Ⅱ.定量探究(1)步骤①加入样品前还应检查装置的气密性,(2)因为装置乙中试剂为浓硫酸,故其作用是吸收二氧化碳中混有的水蒸气,实验步骤③中,甲装置的作用是吸收鼓入空气中的二氧化碳,防止出现较大误差

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源:不详 题型:单选题
| A.用Al(OH)3治疗胃酸过多症:Al(OH)3+3HCl==AlCl3+3H2O |
| B.实验室用稀硫酸与铜片反应制取H2:Cu+H2SO4==CuSO4+H2↑ |
| C.用铁粉从含硝酸银的废水中提取金属银:Fe+3AgNO3==Fe(NO3)3+3Ag |
| D.用点燃的方法除去二氧化碳气体中混有的少量一氧化碳:2CO+O2点燃 2CO2 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量 氯化钙 ,振荡,静置 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加 | | 产物不含NaOH |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象及结论 |
| | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 |
| ①将几粒白色固体颗粒放在表面皿上,放置一会儿 | |
| ②将几粒白色固体颗粒放入盛有少量水的试管中,并用手触摸试管外壁 | |
| ③向操作②得到的溶液中放入一段羊毛线,加热一段时间 | 羊毛线逐渐消失 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 编号 | 可燃物 | 现象(是否燃烧) | 影响因素 | |
| 是否与氧气接触 | 温度是否达到着火点 | |||
| ① | 铜片上的白磷 | 燃烧 | √ | √ |
| ② | 铜片上的红磷 | 不燃烧 | √ | × |
| ③ | 热水中的白磷 | 不燃烧 | × | √ |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
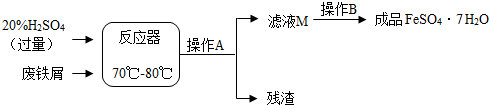
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||||
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量工业烧碱样品配成溶液后,滴加过量 | | 工业烧碱中含有碳酸钠,产生实验现象的化学方程式: 。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com