
【题目】请你参与某学习小组进行研究性学习的过程,并协助完成相关任务。
(研究课题)探究热水壶底部水垢的主要成分。
(查阅资料)该同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小物质-(为碳酸盐、碱等混合物),中一定含有Mg(OH)2和CaCO3同时,他们还查阅到下列有关物质溶解性:
物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
(提出猜想)除一定含有Mg(OH)2和CaCO3之外,还可能含有Ca(OH)2和_____
(设计方案)
(1)甲同学在烧杯中放入少量研碎,加入适量蒸馏水充分搅拌,取上层清液加入Na2CO3溶液,没有白色沉淀,说明中无Ca(OH)2;
(2)乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐成分,步骤如下:
①按图组装仪器,将50g试样放入锥形瓶中,加入足量酸溶液;
②测量一定时间内干燥管内物质增加质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量空气;
④再次称量干燥管内物质增加质量;
⑤重复③和④操作,直至干燥管内物质质量不变
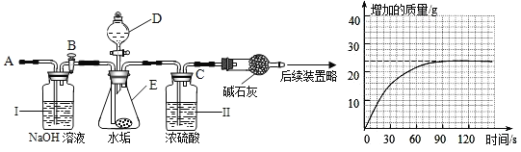
a仪器D、E名称分别是_____、_____;若要检查盛放浓硫酸洗气瓶双孔塞上导气管与橡皮塞接触地方(即上图装置中C处)是否漏气,应在装药品之_____(填“前”或“后”)。
检查,请写出检查C处是否漏气方法:_____。
b步骤①所加酸溶液是_____;请写出中难溶性物质与酸反应化学方程式:_____、_____;
c装置Ⅱ作用是_____;从导管A处缓缓鼓入一定量空气时,装置Ⅰ作用是_____。
d研究性同学通过简单计算,认为中一定含有MgCO3,理由是_____。
(实验结论)通过上述可知:水垢的主要成分有_____。
【答案】MgCO3 分液漏斗 锥形瓶 前 在C处导气管周围滴少量水,关闭B活塞和分液漏斗的活塞,将干燥管左边橡皮管用弹簧夹夹紧,用热毛巾捂锥形瓶,若C处有气泡冒出,说明C处漏气,若C处没有气泡冒出,说明C处不漏气; 稀盐酸 ![]()
![]() 吸收混在二氧化碳气体中的水 除去空气中的二氧化碳 水垢完全反应放出二氧化碳的质量为24g>22g;根据碳酸钙、碳酸镁与盐酸反应放出二氧化碳的关系:等质量的碳酸镁与酸反应放出气体质量大于碳酸钙,因此,水垢中应含有碳酸镁; Mg(OH)2、CaCO3、MgCO3
吸收混在二氧化碳气体中的水 除去空气中的二氧化碳 水垢完全反应放出二氧化碳的质量为24g>22g;根据碳酸钙、碳酸镁与盐酸反应放出二氧化碳的关系:等质量的碳酸镁与酸反应放出气体质量大于碳酸钙,因此,水垢中应含有碳酸镁; Mg(OH)2、CaCO3、MgCO3
【解析】
[提出猜想]
碳酸镁微溶于水,因此水垢中可能含有碳酸镁;
[设计方案]
(1)由溶解性表,要检查氢氧化钙是否存在,可利用向溶液中滴加碳酸钠溶液的方法,因为观察到反应没有出现白色沉淀,所以判断氢氧化钙不存在;
(2)a.仪器D为添加液体药品的分液漏斗;而装置E用作反应容器的锥形瓶;在向装置中加入药品进行实验前,要检查装置的气密性;装置漏气主要是出现仪器连接处,因此在C处导气管周围滴少量水,关闭B活塞和分液漏斗的活塞,将干燥管左边橡皮管用弹簧夹夹紧,用热毛巾捂锥形瓶,若C处有气泡冒出,说明C处漏气,若C处没有气泡冒出,说明C处不漏气;
b.由于碳酸钙与硫酸反应生成微溶于水的硫酸钙会造成反应中止,因此在选择酸时应选择稀盐酸;盐酸与氢氧化镁发生中和反应生成氯化镁和水,碳酸钙与盐酸发生复分解反应生成氯化钙、水和二氧化碳,因此水垢中难溶性物质与酸反应的化学方程式为: ![]() 、
、![]() ;
;
c.装置II中盛放的浓硫酸具有吸水性,在整个装置中起到吸收混在二氧化碳气体中的水的作用;装置I中盛放氢氧化钠溶液,可吸收空气中的二氧化碳,以除去空气中的二氧化碳,防止对后面测定的影响;
d.设50g碳酸钙完全反应生成二氧化碳气体质量为x
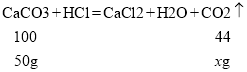
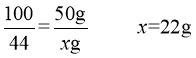
而根据反应记录图,水垢完全反应放出二氧化碳的质量为24g>22g;根据碳酸钙、碳酸镁与盐酸反应放出二氧化碳的关系:等质量的碳酸镁与酸反应放出气体质量大于碳酸钙,因此,水垢中应含有碳酸镁;
[实验结论]
根据资料:水垢中一定含有Mg(OH)2和CaCO3;根据放出二氧化碳的质量为24g的实验数据,通过计算可判断水垢中一定含有碳酸镁;故水垢中含有Mg(OH)2、CaCO3、MgCO3三种物质。


科目:初中化学 来源: 题型:
【题目】已知酸式盐可以和碱发生化学反应,如:![]() 。有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应容器内水分蒸干,最后得到白色固体物质共29g,则原混合物中含Na2CO3的质量是( )
。有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应容器内水分蒸干,最后得到白色固体物质共29g,则原混合物中含Na2CO3的质量是( )
A.10.6g
B.5.3g
C.15.9g
D.无法确定
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学想在实验室里用NaOH溶液制取Na2CO3溶液。
查阅资料:①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象
②NaHCO3溶液煮沸时不会发生分解
③![]()
④Ca(HCO3)2可溶于水
制取步骤:①量取两份50mL相同浓度的NaOH溶液备用;
②用一份50mLNaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1~2分钟;
④_____,即得Na2CO3溶液。
实验探究:为了检验制得的溶液是否为纯净的Na2CO3溶液,请你与该同学一起完成下列实验探究:
实验步骤 | 实验现象 | 实验结论 | |
取少量制得的溶液于试管中,加入过量的_____溶液 | 产生白色沉淀 | 原来溶液含有Na2CO3 | |
将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的_____ | 无气泡产生 | 原来制得的溶液中不含_____ |
取另一份加入MgCl2溶液 | _____ | 原来制得的溶液中不含NaOH | |
结论:所制得的溶液为纯净的Na2CO3溶液
评价与反思:有人认为实验步骤③④的顺序对调,即先混合,再煮沸,更合理。你认为对吗?_____请说明理由:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸二甲酯(C3H6O3)是一种具有重要应用价值和广阔市场前景的绿色化学试剂,熔点4°C、沸点90.1°C。常温下,它是一种无色透明、略有刺激性气味的液体,具有无毒、无腐蚀性、含氧量高、相溶性好的特点。下列有关说法中不正确的是
A.碳酸二甲酯被视为绿色化学试剂,跟它无毒、无腐蚀性有关
B.碳酸二甲酯分子中含有3个碳原子和3个水分子
C.碳酸二甲酯由碳、氢、氧三种元素组成
D.碳酸二甲酯的氧含量高达53.3%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知:含有碳、氢元素的有机物在氧气中完全燃烧,产生二氧化碳和水。某混合气体在氧气中完全燃烧后的产物依次通过浓硫酸和氢氧化钠溶液,经完全吸收后,测得浓硫酸和氧氧化钠溶液增重的质量比为9:11,则该气体的可能组合是( )
①CH4 ②CO ③C2H2 ④C2H4 ⑤H2
A.①②③
B.①③④
C.①②⑤
D.②③④
查看答案和解析>>
科目:初中化学 来源: 题型:
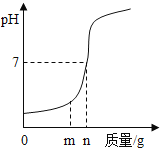
【题目】用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如右图所示。熟石灰与盐酸反应的化学方程式为____。当加入熟石灰mg时,溶液中的溶质为._____。若改用ng氢氧化钠与相同盐酸反应,所得溶液的pH___7(填“>”、“<”或“=”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
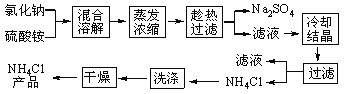
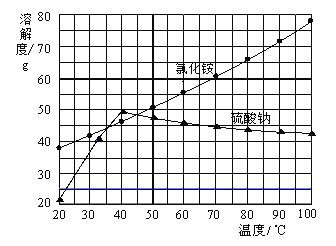
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl_____g。
(2)实验室进行蒸发浓缩用到的主要仪器有_____、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_____。
(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是_____。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲烷可制备水煤气,该反应前后分子种类变化的微观示意图如下。下列说法正确的是
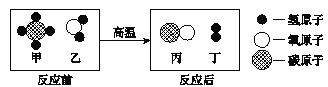
A.1个甲分子中含有4个原子
B.生成的丙与丁的质量比为14:3
C.该反应为置换反应
D.反应中含氢元素的化合物有3种
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
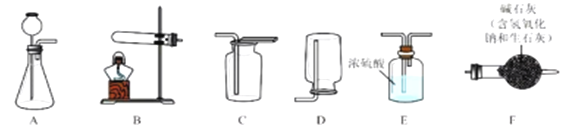
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com