
С��ͬѧ��ⶨCu��Zn�Ͻ��Cu��Ag�Ͻ���ͭ������������ʵ����ֻ�ṩһƿδ��������������ϡ����ͱ�Ҫ��������
��1������Ϊ�ܲ��Cu�������������������Ͻ�
��2��С��ͬѧȡ�úϽ�32.5g���������ĸ������ַ�Ӧ�����ⶨ��������0.4g���壮�����úϽ���Cu������������
��3�����������������������������Ϊʵ��ʱ�����ṩ�Ͳ����Щ���ݣ�������
�ٲμӷ�Ӧ�ĺϽ����� �ڲμӷ�Ӧ��ϡ��������� �۲��������������
�����㡿���ݻ�ѧ��Ӧ����ʽ�ļ��㣻�����Ļ�ѧ���ʣ�
��ר�⡿�йػ�ѧ����ʽ�ļ��㣮
����������1���������ṩ��ҩƷ��֪������Ҫ����ĺϽ��е����ֽ�������һ������֮ǰ��һ������֮��
��2��������ǰ����������ķ�Ӧ�������п�ͽ���ͭ����������������Ͻ���ͭ������������
��3��Ҫ������������ʵ�����������������������ʺ���Һ������������Һ��������Ҫ��������ʵ�������Ҫ���������������������������
����𡿽⣺��1��ͭ�Ļ�Ա�����������ϡ�ᷢ����Ӧ��п�Ļ�Ա���ǿ������ϡ�ᷢ����Ӧ�����ͭп�Ͻ��ܲⶨ��ͭ�����������������Ļ�Ա�������Ҳ����ϡ�ᷢ����Ӧ�����ͭ���Ͻ��ܲⶨ��ͭ������������
��2���裺�Ͻ���п������Ϊx
Zn+2HCl=ZnCl2+H2��
65 2
x 0.4g


x=13g
�Ͻ���ͭ������Ϊ��32.5g��13g=19.5g
�Ͻ���ͭ����������=
 ��100%=60%
��100%=60%
�𣺺Ͻ���ͭ����������Ϊ60%��
��3��Ҫ�������������������������֪�����������ʵ���������Һ���������μӷ�Ӧ�����������ʵ�����������������������ͨ����ѧ����ʽ�������Ȼ�����ʵ�������ϡ�������������100%��Ϊ��������������������μӷ�Ӧ�ĺϽ�������ǻ��������������м���ʱ����ֱ��ʹ�ã�ʵ��ʱ�������μӷ�Ӧ��ϡ�����������������������������ѡBC��CD��
�ʴ�Ϊ��
��1��Cu��Zn��
��2���úϽ���Cu����������Ϊ60%��
��3��BD����CD����
�����������⿼��������˳����Ӧ�ã�ͬʱ������ݻ�ѧ����ʽ�ļ��㣬���Ӳ�ͬ�Ƕȿ���ѧ�����������������
��


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ѽ��ѵĺϽ���Ϊ��21������Ҫ�Ľ������ϣ��ؿ��е��ѿ�ʯ��Ҫ�ǽ��ʯ��TiO2����TiO2���ѵĻ��ϼ���������Ŀǰ��ҵ����ȡ�ѵķ����ǣ���һ�����ڸ���ʱ�������ʯ��̿�ۻ�ϲ�ͨ��������Cl2���Ƶ�TiCl4��һ�ֿ�ȼ�����壬�÷�Ӧ�Ļ�ѧ����ʽ���������ڶ��������������������������μӷ�Ӧ���Ļ����У��ù����Ľ���þ�ڼ�����������TiCl4��Ӧ�Ƶý����ѣ��÷�Ӧ�Ļ�ѧ����ʽ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��
������ʾ���Ǵ����ʵ����������ڲ����IJ�������������������ȷ����������
A��

��ǩ����ʴ
B��

�Թ�����
C��

������ľƾ���
D��

����ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Zn��Fe2O3��Cu��OH��2��ϡH2SO4�������ʣ��ڳ����������������ܷ����Ļ�ѧ��Ӧ�У�������
A��3�� B��4�� C��5�� D��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ճ������У��п���ƻ���ܿ�ͻ�
�����⡱��С���鵽��������ϣ���ƻ�����п�ʱ��
����������ͻ���ƻ���е�һЩ���ʷ�����Ӧ��ʹ֮��ɺ�ɫ��ƻ�������⡱�Ժ�������ά����C����٣�Ӱ��Ӫ����ֵ��С���Դ�չ��̽����
���룺ƻ�������⡱����������е������йأ������⡱�Ŀ������������¶��йأ�
ʵ�飺
ʵ��������۲�30���ӣ� ʵ����
�� ��һС��ƻ������װ������ˮ���ѳ�ȥ�������ļ���ƿ�У��۲����� ������治��ɫ
�� ��һС��ƻ��������������ļ���ƿ�У��۲����� �����������
�� ��һС��ƻ��������������ļ���ƿ�У��ٽ�����ˮ��۲����� �������ܿ��ɫ����ɫ����
��1������������ʵ�������֤ƻ�������⡱�Ƿ�������е������йأ�
��2��ʵ�����֮һ��ƻ�������⡱���ٶ����¶��йأ��¶�Խ�ߣ���ɫԽ�죮���㲹�������ʵ�������������������
��3��Ϊ�˷�ֹ�п����ƻ�������⡱�����Բ�ȡ�Ĵ�ʩ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʷ���ˮ�У������γ���Һ���ǣ�������
A������ B������ C��ζ�� D�� �״�
�״�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������۵���ϵ�ǻ�ѧѧ�����е�˼ά��ʽ�����ж��ں��������۽����У�������ǣ�������
A��ˮֱͨ����ֽ⣬����Ϊˮ���ӱ��ƻ����γ��µķ���
B�������㲻���������˵���˷����ڲ����˶�
C��һ����̼�Ͷ�����̼���в�ͬ�Ļ�ѧ���ʣ�����Ϊ�������ǵķ��Ӳ�ͬ
D��20mLˮ�� 20mL�ƾ���Ϻ����С��40mL������Ϊ������Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ͨ��������ѧϰ��������ʶ�˶������ʣ���ᵽ���Ƕ����ʵ��о���һ�ֿ�ѧ̽���Ĺ��̣����տ�ѧ�ij�������о���������о���Ч�ʣ���������ϸ�Ķ����ϣ����ݲ�����д���пո�
þ��һ������Ľ�����20���Ͳŷ�չ��������������ɫ���۵�649�棬���ᣬ�ܶ�ԼΪͭ��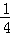 ������
������
 ��þ�ڿ�����ȼ�գ�����ҫ�۰⣬ͬʱ���ɰ�ɫ��������þ��MgO�����Ŵ����ȣ�þ�ڵ�����ȼ�ձȿ�����ȼ�ո���������ҫ�۰⣬���ɵ���ɫ���嵪��þ��Mg3N2�����Ŵ����ȣ�þ�ڶ�����̼���Ծ���ȼ�գ�����ҫ�۰⣬���ɰ�ɫ��������þ��MgO���ͺ�ɫ����̼��C�����Ŵ����ȣ�þ����ˮ��Ӧ����������þ���������ų�����������þȼ����ֵ�ߣ�ȼ��ʹ����ҫ�۵Ļ��棬��þ������������ȼ�յ������ȣ����⣬þ�Ͻ��ǿ�ȸߡ���е���ܺã���Щ����ʹ����þ��Ϊ�����������ɻ����������Ҫ���ϣ��Ӷ���á���������������������ҵ���Ժ�ˮΪԭ�ϣ�ͨ��һϵ�л�ѧ�仯�õ��Ȼ�þ���壻�����ˮ�Ȼ�þ��MgCl2��������״̬�£�ͨ���������Mg����������Cl2�����÷�Ӧ�ķ��ű���ʽΪ��MgCl2
��þ�ڿ�����ȼ�գ�����ҫ�۰⣬ͬʱ���ɰ�ɫ��������þ��MgO�����Ŵ����ȣ�þ�ڵ�����ȼ�ձȿ�����ȼ�ո���������ҫ�۰⣬���ɵ���ɫ���嵪��þ��Mg3N2�����Ŵ����ȣ�þ�ڶ�����̼���Ծ���ȼ�գ�����ҫ�۰⣬���ɰ�ɫ��������þ��MgO���ͺ�ɫ����̼��C�����Ŵ����ȣ�þ����ˮ��Ӧ����������þ���������ų�����������þȼ����ֵ�ߣ�ȼ��ʹ����ҫ�۵Ļ��棬��þ������������ȼ�յ������ȣ����⣬þ�Ͻ��ǿ�ȸߡ���е���ܺã���Щ����ʹ����þ��Ϊ�����������ɻ����������Ҫ���ϣ��Ӷ���á���������������������ҵ���Ժ�ˮΪԭ�ϣ�ͨ��һϵ�л�ѧ�仯�õ��Ȼ�þ���壻�����ˮ�Ȼ�þ��MgCl2��������״̬�£�ͨ���������Mg����������Cl2�����÷�Ӧ�ķ��ű���ʽΪ��MgCl2 Mg+Cl2
Mg+Cl2
��1��þ�����������У���д����������������
��2��þ�ǻ�ѧ������������д���ܻ��á��ܲ����á����Ľ������ӷ����о����ʽǶȹ��ɣ�þ�ֱ���������������������ѧ��Ӧ��
��3��þ����;�У���д������������������
��4����ҵ��þ�����е����һ����Ӧ����ˮ�Ȼ�þ��MgCl2��������״̬�µ�⣬�÷�Ӧ�Ļ�������������
��5��ij�洢þ�۵IJֿ����������Ա��ȡ�˸���ɳ���ķ�����������������ԱΪʲô����ˮ�������̼������������������������Ϣ������ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ۺ�����ͭ�Ļ������뵽һ�����������У���ַ�Ӧ����ˣ�����Һ�м����������ۣ������������ж���ȷ���ǣ�������
A��������һ������ͭ B������������ͭ�����Ļ����
C����Һ�к���FeCl2������ D����Һ�к���FeCl2��CuCl2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com