
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液颜色为紫色 | 酸碱恰好完全反应 |
| 方案三 | 取样,滴入几滴无色酚酞溶液 | 溶液变红 | 氢氧化钠过量,溶质为氢氧化钠和硫酸钠 |
分析 【实验原理】反应物是氢氧化钠和硫酸,生成物是硫酸钠和水,用观察法配平,写出方程式;
【实验评价】:
方案一:验证硫酸根离子的存在,必须排除隐含在溶液中的硫酸根离子的存在;
方案二:根据紫色石蕊遇酸变红,遇碱变蓝,遇中性不变色,所以若观察到溶液为紫色解答;
方案三:根据滴入几滴无色酚酞溶液,酚酞变红,只能说明溶液呈碱性,氢氧化钠过量,溶质为氢氧化钠和硫酸钠解答;
①根据氢氧化钠和硫酸恰好完全反应时,生成硫酸钠和水,硫酸钠和氯化钡溶液也产生白色沉淀解答;
②根据紫色石蕊遇酸变红进行解答.
解答 解:【实验原理】氢氧化钠和硫酸反应生成硫酸钠和水,化学方程式是:2NaOH+H2SO4=Na2SO4+2H2O;
【实验探究】方案二:取样,滴入几滴紫色石蕊溶液,紫色石蕊遇酸变红,遇碱变蓝,遇中性不变色,所以若观察到溶液为紫色,则说明酸碱恰好完全反应;
方案三:取样,滴入几滴无色酚酞溶液,酚酞变红,只能说明溶液呈碱性,氢氧化钠过量,溶质为氢氧化钠和硫酸钠;
①硫酸根离子和钡离子反应会生成硫酸钡沉淀,所以方案一中,向溶液中滴加氯化钡溶液,即使稀硫酸不过量,也会出现白色沉淀,因为溶液中有生成的硫酸钠,存在硫酸根离子;
②紫色石蕊遇酸变红色,所以实验方案为:取样,滴入几滴紫色石蕊溶液,液变红,溶液呈酸性,说明硫酸过量.
故答案为:【实验原理】2NaOH+H2SO4=Na2SO4+2H2O;
【实验探究】
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液颜色为紫色 | 酸碱恰好完全反应 |
| 方案三 | 取样,滴入几滴无色酚酞溶液 | 溶液变红 | 氢氧化钠过量,溶质为 氢氧化钠和硫酸钠 |
点评 本题主要是考查学生的综合分析能力,不但要求学生具备有关化合物的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.


科目:初中化学 来源: 题型:选择题
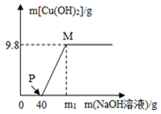 含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,则下列说法不正确的是( )
含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,则下列说法不正确的是( )| A. | m1的数值为80 | |
| B. | P点溶液中的溶质是氯化钠和氯化铜 | |
| C. | M点溶液中的溶质是氯化钠 | |
| D. | 整个反应过程中,溶液中氯离子个数不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
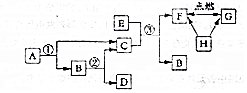 A-H是初中化学常见的物质,它们的相互转化关系如图所示.已知A、B组成元素相同且都是由两种元素组成的,F、G、H三种物质含有同种非金属元素,其中H是单质,G是易与血液中血红蛋白结合的有毒气体,请回答下列问题.(有些转换关系,反应条件等略去).
A-H是初中化学常见的物质,它们的相互转化关系如图所示.已知A、B组成元素相同且都是由两种元素组成的,F、G、H三种物质含有同种非金属元素,其中H是单质,G是易与血液中血红蛋白结合的有毒气体,请回答下列问题.(有些转换关系,反应条件等略去).查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 100 g水中溶解了10 g食盐 | |
| B. | 100 g食盐溶液中溶解了10 g食盐 | |
| C. | 将10 g食盐溶解于90 g水中所得的溶液 | |
| D. | 将食盐、食盐水按1:10的质量比配成的溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com