
| A. | 亮氨酸是氧化物 | B. | CaSO4中钙为+2价 | ||
| C. | 亮氨酸中碳、氢元素个数比为6:13 | D. | 亮氨酸由22个原子构成 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:推断题
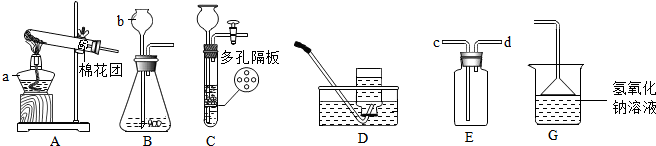
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
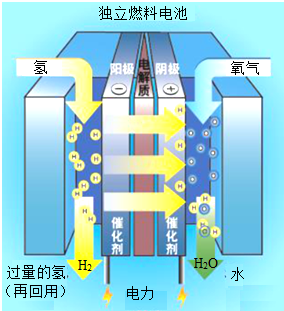 阅读下面的科普短文.
阅读下面的科普短文.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氮水挥发--分子不断运动 | |
| B. | 湿衣服在阳光下比在阴凉处干得快--温度越高,分子运动速率越快 | |
| C. | 6000L氧气在加压的情况下可装入容积为40L的钢瓶中--氧分子数减少 | |
| D. | 一氧化碳和二氧化碳具有不同的化学性质--分子构成不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验步骤 | 观察到的现象 | 获得结论 | 有关反应的化学方程式 |
| 取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 | 固体完全溶解,溶液变蓝 | 黑色粉末均为氧化铜 | CuO+H2SO4=CuSO4+H2O |

| 反应前 | 反应后 |
| 玻璃管和内盛氧化铜粉末的总质量为62.0g | 玻璃管和内盛红色粉末的总质量为61.7g |
| 玻璃管的质量为60.0g | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验编号 | 硫酸的质量分数(均取200mL) | 锌的颗粒大小(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌粉 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌粉 | 75.4 |
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| 氢气的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | FeCl2(溶液) | CuCl2(溶液) | 铁粉、过滤 |
| B | CO2(气体) | HCl (气体) | 氢氧化钠溶液 |
| C | NaCl (溶液) | Na2CO3(溶液) | 稀硫酸 |
| D | KCl(固体) | MnO2 (固体) | 水、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 化学就在我们身边.
化学就在我们身边.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com