
 如图是a、b、c三种物质的溶解度曲线.下列叙述错误的是( )
如图是a、b、c三种物质的溶解度曲线.下列叙述错误的是( )| A. | t1℃时,a、c的溶解度相等 | |
| B. | t1℃时,a物质饱和溶液中溶质、溶剂的质量比为1:5 | |
| C. | t2℃时a、b、c的饱和溶液降温到0℃后,C液的溶质质量分数最大 | |
| D. | t2℃时30 g a物质的饱和溶液稀释成20%溶液需加入水的质量为20 g |
分析 A、由溶解度曲线,可以比较t1℃时,a、c的溶解度大小.
B、t1℃时,a物质的溶解度为20g,据此进行分析判断.
C、由溶解度曲线图可以看出,在t2℃时abc的溶解度关系为a>b>c,根据饱和溶液中溶质质量分数的计算公式:$\frac{溶解度}{溶解度+100g}$100%,可以判断此时其质量分数关系为a>b>c,降温后a、b溶液中均有晶体析出,还是饱和溶液,但在t1℃时,a的溶解度小于b,所以此时溶质质量分数为:a<b,c的溶解度随温度降低而升高变为不饱和溶液,则溶质质量分数将不变,最后进行综合比较.
D、根据饱和溶液的质量分数$\frac{溶解度}{溶解度+100g}$=100%、溶液稀释前后溶质的质量不变,结合题意进行分析判断
解答 解:A、t1℃时,a、c的溶解度曲线交于一点,a、c的溶解度相等,故选项说法正确.
B、t1℃时,a物质的溶解度为20g,t1℃时,a物质饱和溶液中溶质、溶剂的质量比为20g:100g=1:5,故选项说法正确.
C、由溶解度曲线图可以看出,在t2℃时abc的溶解度关系为a>b>c,根据饱和溶液中溶质质量分数的计算公式:$\frac{溶解度}{溶解度+100g}$100%,可以判断此时其质量分数关系为a>b>c,降温后a、b溶液中均有晶体析出,还是饱和溶液,但在t1℃时,a的溶解度小于b,所以此时溶质质量分数为:a<b,c的溶解度随温度降低而升高变为不饱和溶液,由于溶液的组成未发生改变,则溶质质量分数将不变;由于t1℃时a的溶解度大于t2℃时c的溶解度,故所得溶液的溶质质量分数由大到小的顺序是bac,故选项说法错误.
D、t2℃时a物质的饱和溶液中溶质质量分数为$\frac{50g}{50g+100g}$100%≈33.3%,设要加水的质量为x,根据溶液稀释前后,溶质的质量不变,则30g×33.3%=(30g+x)×20% x=20g,故选项说法正确.
故选C.
点评 本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.


科目:初中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:初中化学 来源: 题型:解答题
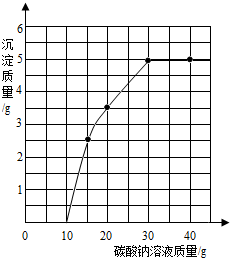 实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.
实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
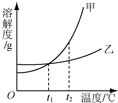
| A. | 依据溶解度曲线可判断,甲的溶解度比乙的大 | |
| B. | 将等质量甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量小 | |
| C. | 将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法 | |
| D. | 除去甲物质中少量乙物质可采取降温结晶的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
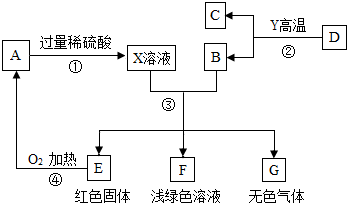 A、B、C、D、E、F、G为初中化学常见的物质,其中B、E、G属于单质,反应②是以赤铁矿为原料炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
A、B、C、D、E、F、G为初中化学常见的物质,其中B、E、G属于单质,反应②是以赤铁矿为原料炼铁工业中的主要反应,它们之间的相互转化关系如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 除去氯化钠溶液中的碳酸钠 | B. | 除去熟石灰中的石灰石 | ||
| C. | 除去铜粉中混有的铁粉 | D. | 除去铁丝上的铁锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验操作 | 实验现象 | 实验结论 |
| 分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl.观察现象. | 加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢. | 证明是Fe3+影响过氧化氢的分解速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com