
【题目】如图为测定空气中氧气含量的实验装置,下列做法合理的是( )
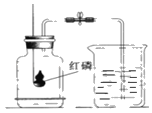
A. 红磷熄灭后,立即打开止水夹
B. 红磷点燃后,缓慢伸入瓶中并塞紧橡皮塞
C. 用过量的红磷进行实验
D. 用木炭代替红磷进行实验
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:初中化学 来源: 题型:
【题目】实验室有一瓶过氧化氢溶液,标签如图。

试回答:
(1)实验室制取氧气时,通常要将30%的H2O2溶液稀释,其可能原因是_______。
(2)实验中需用6%的过氧化氢溶液100g,需30%的H2O2溶液体积为_____mL,加水为_________mL 。
(3)某同学取6.8g上述稀释后的溶液,用KMnO4溶液来测定其浓度,反应的化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+SO2↑+8H2O,恰好完全反应时消耗溶质KMnO4质量为0.632g,计算稀释后溶液的实际浓度_________(写出计算过程)。
(4)若溶液稀释过程是正确的,则实际浓度偏低的可能原因是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图是甲、乙两物质的溶解度曲线,下列说法正确的是
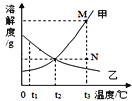
A. 两种物质的溶解度大小顺序为甲﹥乙
B. 若要将M点的甲溶液转变为N点的甲溶液,降温即可
C. 分别将甲、乙的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数大小关系是甲﹥乙
D. t3℃时,将甲、乙的饱和溶液各蒸发50g水,析出晶体质量甲﹥乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用下列仪器进行气体的制取实验,请根据要求填空。(夹持仪器已省略)
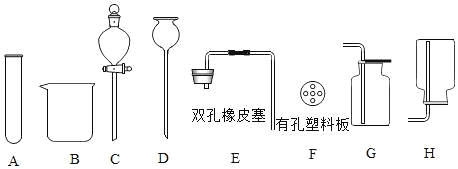
(1)编号A的仪器名称是_____。
(2)用过氧化氢溶液和二氧化锰制氧气的发生和收集装置应选_____(填仪器编号)组合,反应的化学方程式是_____。
(3)用ADEF组装的发生装置_____(填“能”或“不能”)用于实验室制二氧化碳,该装置_____(填“能”或“不能”)达到随时可使反应发生或停止的目的。
(4)12.5g含碳酸钙80%的大理石与足量的盐酸反应,计算生成二氧化碳的物质的量(根据化学方程式计算)_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】关于化学反应A+B=C+D,下列说法中正确的是( )
A. 若生成物C和D分别是盐和水,则反应物一定是酸和碱
B. 若C是单质、D为化合物,则A和B中一定有一种是单质,一种是化合物
C. 若A是可溶性碱,B是可溶性盐,则C和D可能是两种沉淀
D. 若A、B各取10g混合,使其充分反应,则C、D质量的总和一定等于20g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化锌广泛用于皮肤病的治疗,工业氧化锌常含有少量杂质(CuO、FeO、SiO2等)不能直接使用。提纯、净化氧化锌的简易流程如图所示:
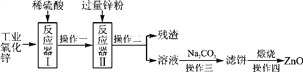
参考资料:SiO2既不溶于水也不与酸反应。
(1)反应器Ⅰ中加入足量稀硫酸,充分反应后,生成硫酸盐的化学式为________________________________________________________________________。
(2)残渣中除金属锌外,还有________。
(3)操作一、操作二和操作三采用的分离方法是________。
(4)操作四发生反应的化学方程式为________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某固体混合物可能含有Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl中的一种或几种,为了确定该混合物的成分,进行如下实验:
步骤I:将固体混合物溶于水,搅拌后得无色透明溶液
步骤II:往此溶液中滴加足量硝酸钡溶液,有白色沉淀生成
步骤III:过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解,并放出气体。试判断:
(1)固体混合物中肯定有_____,肯定没有_____,可能有_____
(2)对可能有的物质,可采用向步骤III中的滤液滴加_____溶液来检验。
(3)写出步骤III中发生的化学方程式_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳,而Na2CO3受热不分解.现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3,某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案.
方案一:样品![]() 测定生成CO2的质量.
测定生成CO2的质量.

(1)本实验采用如图所示的装置,C中盛放的物质是 .
(2)若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下, (填“能”或“不能”)准确测定样品中NaHCO3的质量分数.
方案二:样品![]() 测定剩余固体质量.
测定剩余固体质量.
具体操作步骤如下:
①一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克.
(3)实验时需要重复“加热、冷却、称量”操作多次,其目的是 .
(4)根据题意,计算样品中NaHCO3的质量分数,写出计算过程.
(已知2NaHCO3![]() Na2CO3+H2O+CO2↑)
Na2CO3+H2O+CO2↑)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com