
| A. | 碱面 | B. | 植物油 | C. | 白糖 | D. | 食盐 |
分析 一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;只有被分散的物质在水中是可溶的,二者混合后才会形成溶液.
解答 解:A、碱面是碳酸钠的俗称,易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
B、植物油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项正确.
C、白糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
D、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
故选:B.
点评 本题难度不大,掌握溶液的本质特征(均一性、稳定性、混合物)、各种物质的水溶性方面的知识是解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 7.6g气体全部是O2 | |
| B. | 7.6g气体通过足量NaOH溶液后,气体减少4.4g | |
| C. | 反应后的固体是混合物 | |
| D. | 生成Na2CO3的质量为31.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 热胀冷缩,说明分子的大小随温度升降而改娈 | |
| B. | “酒香不怕巷子深”,说明分子在不停地运动 | |
| C. | 10mL酒精和10mL水混合后,体积小于20mL,说明分子间有空隙 | |
| D. | 水通电分解生成氢气和氧气,说明分子在化学变化中可再分 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
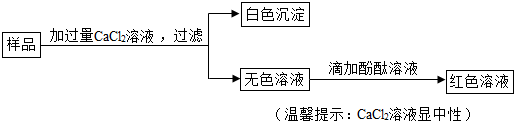
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁在空气中剧烈燃烧,生成黑色固体 | |
| B. | 氯化铵固体和熟石灰混合研磨,生成无色无味的气体 | |
| C. | 分别点燃一小块棉纤维和羊毛纤维,都产生了烧焦羽毛的气味 | |
| D. | 把带有火星的木条伸入盛有氧气的集气瓶中,木条复燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
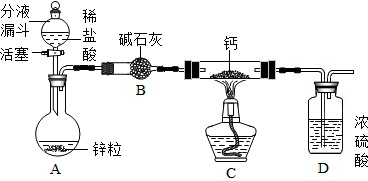
| 实验 | 现象 | 结论 |
| 实验一:取滤液,向其中滴入少量 Na2CO3溶液 | 无明显现象 | 猜想二不成立 |
| 实验二:另取滤液,向其中加入足量稀盐酸 | 过一会儿有气泡产生 | 猜想三成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
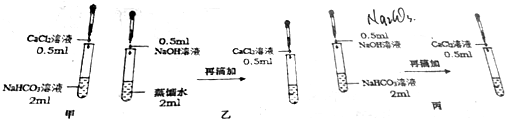
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
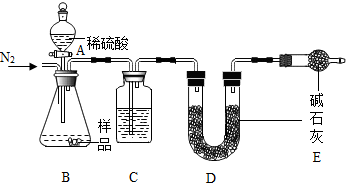 已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳.而Na2CO3受热不分解.现有某工厂生产出的一批
已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳.而Na2CO3受热不分解.现有某工厂生产出的一批查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com