
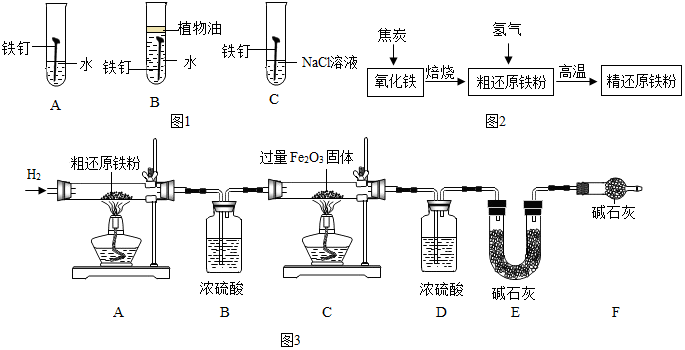
分析 (1)根据金属锈蚀的条件来分析;
(2)根据化学方程式的写法来分析;
(3)根据信息结合金属活动顺序分析;
(4)根据质量守恒定律分析;铁能与硫酸铜反应生成硫酸亚铁和铜,可观察到铁丝表面出现红色固体,溶液由蓝色逐渐变为无色;
(5)焦炭燃烧放出大量的热,该热量可维持其它反应的发生;CO具有还原性,能与氧化铁反应而使氧化铁还原成铁,同时放出二氧化碳;
(6)根据实验的注意事项以及有关化学式的计算来分析;
(7)根据反应的原理以及有关化学式的计算来分析;
(8)装置F可以吸收空气中的二氧化碳与水蒸气;
(9)根据化学方程式进行计算.
解答 解:(1)铁生锈时,需要水分和氧气同时存在,当有盐类物质存在时,生锈速度加快,根据铁的锈蚀条件可知,保持铁制品表面的干燥洁净,在其表面覆盖保护层,如喷漆、涂油等均可防锈;故填:C;喷漆(答案合理即可);
(2)氢氧化亚铁与水、氧气反应生成氢氧化铁,故填:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)为减缓海水对铁质海轮外壳的腐蚀,制造海轮时,会在海轮船底四周镶嵌比铁更活泼的金属,三种金属中只有锌的活动性比铁强;故选项为:C;
(4)①根据质量守恒定律,反应前后原子的种类和数目不变,反应前:Fe原子数目为36,Na原子的数目为13,N原子的数目为13,O原子的数目为57,H原子的数目为52;反应后:Fe原子数目为0,Na原子的数目为13,N原子的数目为13,O原子的数目为13,H原子的数目为52;所以,X的化学式为Fe3O4
②如果氧化膜不致密,裸露出来的铁与硫酸铜的反应生成了铜和硫酸亚铁,反应的方程式为Fe+CuSO4 ═FeSO4 +Cu.
故答案为:①Fe3O4;②Fe+CuSO4=Cu+FeSO4;
(5)焦炭燃烧放出大量的热,产生的热量使装置内其它反应得以发生;故填:提供热量;
氧化铁在高温条件下能与CO发生反应生成铁与二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(6)实验开始时要先通入纯净干燥的H2,目的是除去装置内的空气(或氧气),防止发生爆炸;装置B增重0.36g,也就是FexOy+yH2$\frac{\underline{\;高温\;}}{\;}$xFe+yH2O反应中生成水的质量为0.36g,则这些水中含氧元素的质量为:0.36g×$\frac{16}{18}×100%$=0.32g;则样品中氧元素的质量分数是$\frac{0.32g}{20.00g}×100%$=1.6%;故填:1.6%;
故填:除去装置内的空气(或氧气),防止发生爆炸;1.6%;
(7)由装置C中发生的反应可知,氧化铁转化为铁,观察到的现象是红棕色粉末慢慢变成黑色;装置E增加的质量为0.44g,即生成了0.44g二氧化碳,这些二氧化碳中含碳元素的质量为:0.44g×$\frac{12}{44}×100%$=0.12g,则样品中碳元素的质量分数是$\frac{0.12g}{20.00g}×100%=0.6%$;故填:红棕色粉末慢慢变成黑色;0.6%;
(8)装置F可以吸收空气中的二氧化碳与水蒸气,否则装置F会吸收空气中的二氧化碳和水造成质量偏大,误认为生成的二氧化碳多,造成测定结果偏大;故填:偏大;
(9)D、E装置中增重的质量分别为C中生成水与二氧化碳的质量之比,由3CH4+4Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+6H2O+8Fe可知,生成的水与二氧化碳的质量之比为:(18×6):(44×3)=108:132=9:11;当时原来通入的氢气在C装置中也会还原氧化铁生成部分水,所以D、E装置中增重的质量之比为大于9:11;故填:>.
点评 通过对铁冶炼原理的知识迁移,理解该题的实验过程及目的,考查了知识的运用及实验分析的能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:初中化学 来源: 题型:推断题
 如图中A-G都是初中化学中常见的物质,已知A、B都是黑色固体,D为红色固体,E是一种支持燃烧的气体,F是石灰水的主要成分,G是一种难溶性的固体,它们的转化关系如图所示.
如图中A-G都是初中化学中常见的物质,已知A、B都是黑色固体,D为红色固体,E是一种支持燃烧的气体,F是石灰水的主要成分,G是一种难溶性的固体,它们的转化关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
| 实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
| 实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | 氯酸钾 | 580 |
| ② | 氯酸钾和二氧化锰(质量比1:1) | 350 |
| ① | 氯酸钾和氧化铜(质量比1:1) | 370 |
| ② | 氯酸钾和氧化铁(质量比1:1) | 390 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
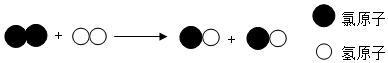
| A. | 化学反应前后分子的种类不变 | B. | 化学反应前后物质的种类不变 | ||
| C. | 该反应是化合反应 | D. | 化学反应前后原子的个数改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com