
分析 化学反应前后,元素的种类不变,原子的种类、总个数不变;
二氧化硫和氧气在催化剂作用下反应生成三氧化硫,三氧化硫和水反应生成硫酸;
高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
浓硫酸具有强腐蚀性,溶于水放出大量的热.
解答 解:(1)矿石粉在沸腾炉中燃烧的反应方程式为:4FeS2+11O2=2Fe2O3+8SO2.
故填:4FeS2+11O2=2Fe2O3+8SO2.
(2)若以SO2为原料生产硫酸,其过程中的反应均为化合反应,写出其反应的化学方程式:
二氧化硫和氧气在催化剂作用下反应生成三氧化硫,三氧化硫和水反应生成硫酸,反应的化学方程式为:2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3,.
故填:2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3;H2O;SO3+H2O=H2SO4.
(3)SO2→SO3的反应过程中,V2O5的作用是催化剂.
故填:催化剂.
(4)高炉炼铁主要反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(5)稀释操作时,必须将浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌,否则会造成危险.
故填:浓硫酸沿着烧杯内壁缓缓注入水中,并且用玻璃棒不断搅拌.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:初中化学 来源: 题型:实验探究题
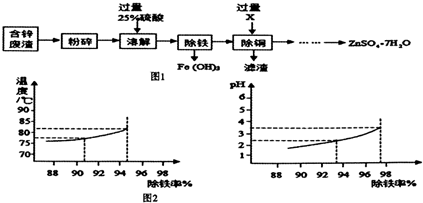
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
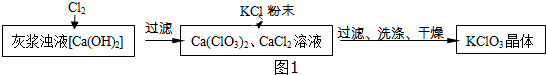
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
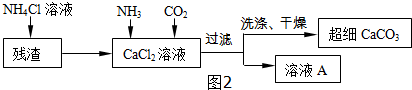
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
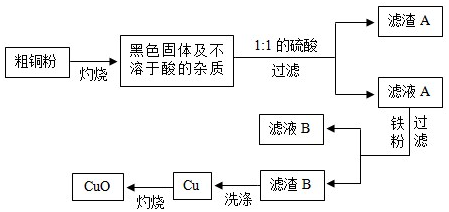
科目:初中化学 来源: 题型:解答题
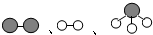 分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序⑤④①②③(将如图五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序⑤④①②③(将如图五张图按反应过程顺序用序号排列).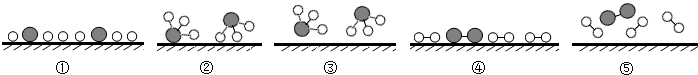
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
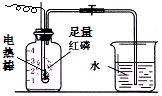 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
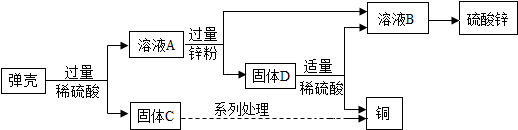
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com