


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:038
(2005
年南通)水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用.(1)
自来水的生产过程大体如下图: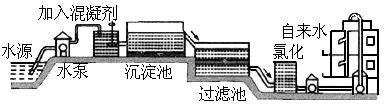
上图过滤池中有活性炭层,活性炭起作用,该过程中发生
________变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸.实验室配制
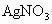 溶液时不宜使用自来水,其原因是(用化学方程式表示)________.高铁酸钾
溶液时不宜使用自来水,其原因是(用化学方程式表示)________.高铁酸钾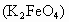 是一种理想的水处理剂,高铁酸钾中铁元素的化合价是________.
是一种理想的水处理剂,高铁酸钾中铁元素的化合价是________.
(2)
电解水时,加入少量NaOH可以增强水的导电性.现将0.1g NaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是________,当溶液中NaOH的质量分数变为0.2%时,有________水被分解.(3)
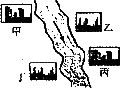
在河旁有甲、乙、丙、丁四座工厂(位置如下图所示),每个工厂排出的废液只含有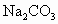 、
、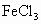 、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
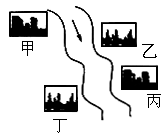
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是
________.②乙处河水呈红褐色的化学方程式是
________.③丁处产生气泡的化学方程式是
________.(4)
保护水资源,我们应该采取的措施是________.查看答案和解析>>
科目:初中化学 来源: 题型:
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
自来水的生产过程大体如下图
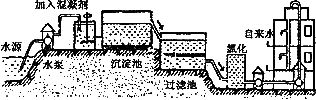
(1)上图过滤池中有活性炭层,活性炭起____作用,该过程中发生________变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配制![]() 溶液时不宜使用自来水。其原因是(用化学方程式表示)_____________________。高铁酸钾(
溶液时不宜使用自来水。其原因是(用化学方程式表示)_____________________。高铁酸钾(![]() )是一种理想的水处理剂,高铁酸钾中铁元素的化合价是__________。
)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是__________。
(2)电解水时,加入少量![]() 可以增强水的导电性。现将O.1
可以增强水的导电性。现将O.1![]()
![]() 溶解在99.9
溶解在99.9 ![]() 水里。接通直流电源后,与电源正极相连的一端放出的气体是________,当溶液中
水里。接通直流电源后,与电源正极相连的一端放出的气体是________,当溶液中![]() 的质量分数变为0.2%时,有_______水被分解。
的质量分数变为0.2%时,有_______水被分解。
(3)在河旁有甲、乙、丙、丁四座工厂(位置如下图所示),每个工厂排出的废液含有![]() 、
、![]() 、
、![]() 、
、![]() 中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是_____。
②乙处河水呈红褐色的化学方程式是______________
③丁处产生气泡的化学方程式是______________
④保护水资源,我们应该采取的措施是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
(1)自来水的生产过程大体如下图:
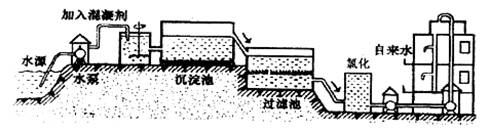
上图过滤池中有活性炭层,该过程中发生 变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配制![]() 溶液时不宜使用自来水,其原因是(用化学方程式表示) 。高锰酸钾(
溶液时不宜使用自来水,其原因是(用化学方程式表示) 。高锰酸钾(![]() )是一种理想的水处理剂,高铁酸钾中铁元素的化合价是 。
)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是 。
(2)电解水时,加入少量![]() 可以增强水的导电性。现将0.1g
可以增强水的导电性。现将0.1g![]() 溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是 ,当溶液中
溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是 ,当溶液中![]() 的质量分数变为0.2%时,有 水被分解。
的质量分数变为0.2%时,有 水被分解。
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有![]() 、
、![]() 、
、![]() 、
、![]() 中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
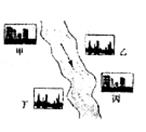
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是 。
②乙处河水呈红褐色的化学方程式是 。
③丁处产生气泡的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com