
【题目】碳酸钠广泛用于造纸、纺织、制革等工业,是一种重要的化工原料。我国侯德榜发明了将制碱与制氨结合起来的联合制碱法,为碳酸钠的工业化生产作出了巨大贡献。
(查阅资料)侯氏制碱法中主要反应:
Ⅰ.NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
Ⅱ.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(实验探究)小明以粗盐配制饱和食盐水,并采用下列装置模拟制备碳酸氢钠,进而制得碳酸钠。
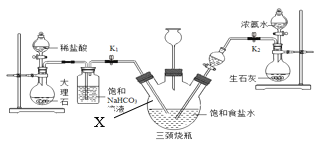
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。请回答下列问题:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,写出对应的化学方程式_____,再过滤,然后向滤液中加入适量_____,得到氯化钠溶液。
(2)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为_____。上述实验装置图中仪器X名称_____。
(3)三颈烧瓶上连接的长颈漏斗的主要作用是_____,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是_____;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是_____。
(4)根据实验记录,计算t2时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_____。
(拓展延伸)小华设计如图的实验装置测定某纯碱样品(含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀硫酸反应,通过排饱和碳酸氢钠溶液测定生成CO2的体积,计算样品中碳酸钠的质量分数。

(已知常温常压下CO2的密度是1.977g/L)
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是_____(填字母)。
A 500mL B 1000mL C 1500mL D 2000mL
(2)若实验中测得碳酸钠质量分数偏小,下列可能的原因是_____。
a.装置漏气
b.读取数据时量气管的液面低于水准管的液面
c.反应结束后烧瓶中有CO2残留
d.读取数据时仰视读数
e.稀硫酸加入烧瓶占据体积
【答案】MgCl2+2NaOH=Mg(OH)2↓+2NaCl 稀盐酸 NaHCO3+HCl=NaCl+H2O+CO2↑ 三颈烧瓶 平衡气压 防止氨气逸出污染环境 使氨气充分反应 50% C ab
【解析】
[实验探究](1)氯化镁与过量氢氧化钠反应生成氯化钠和氢氧化镁沉淀,此时的溶液中除了氯化钠以外,还含有过量的氢氧化钠,可加入适量的盐酸将其中和为氯化钠;故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;稀盐酸;
(2)氯化氢气体溶于水形成盐酸,碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;上述实验装置图中仪器X名称是三颈烧瓶。故填:NaHCO3+HCl═NaCl+H2O+CO2↑;三颈烧瓶;
(3)长颈漏斗与外界空气相同,三颈烧瓶上连接的长颈漏斗的主要作用是平衡气压;有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,因为氨气与水反应形成氨水,氨水能与酸反应,故能防止防止氨气逸出污染环境;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是形成酸性环境,利于使氨气充分反应。故填:平衡气压;防止氨气逸出污染环境;使氨气充分反应;
(4)设原混合物中碳酸氢钠的质量为x
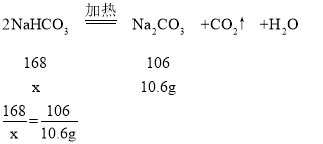
x=16.8g
完全反应时剩余固体减少16.8g-10.6g=6.2g。
t2时固体的质量减少了16.8g-13.7g=3.1g。
t2时固体的质量减少的质量为完全反应时的一半,则t2时NaHCO3固体的分解率为50%。
故填:50%;
[拓展延伸](1)如果5.3g样品全部为碳酸钠的质量,设生成二氧化碳的质量为y,则
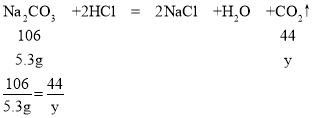
y=2.2g
根据V=![]() =
=![]() =1.1L=1100mL,则实验中选用的量气管规格最合适的是1500mL;故填:C;
=1.1L=1100mL,则实验中选用的量气管规格最合适的是1500mL;故填:C;
(2)a.装置漏气造成收集到的二氧化碳偏少,造成测定结果偏小;
b.读取数据时量气管的液面低于水准管的液面造成量气筒内的压强较大,造成收集的二氧化碳体积偏小,导致测定结果偏小;
c.进入量气筒中液体的体积等于锥形瓶中排出的气体体积,根据量气筒中液体的增加量,即为二氧化碳气体的体积,根据二氧化碳的体积算出碳酸钠的质量分数,因此烧瓶中若有CO2残留对实验结果无影响;
d.读取数据时仰视读数造成读取的二氧化碳体积偏大,导致测定结果偏大;
e.稀硫酸加入烧瓶占据体积造成二氧化碳体积偏大,导致测定结果偏大;
故填:ab。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】利用制磷肥的副产物氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程 如图1,

(1)分解过程发生的反应为:Na2SiF6+4NH3H2O=2NaF+4NH4F+X↓+2H2O。工业上把滤 渣X叫白炭黑,可用于纺织、造纸、食品添加剂领域,其化学式为_____。
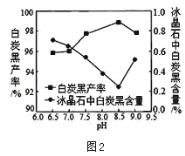
(2)分解时白炭黑产率和冰晶石纯度与 pH 的关系如图 2, 分解时需要控制溶液的 pH=_____最为合适; 能提高其分解速率的措施有_________。(填字母)
A 快速搅拌 B 加热混合液至 100℃ C 增大氨水浓度
(3)写出水浴加热过程中生成冰晶石的化学方程式为_____。
(4)流程中可循环利用的物质是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】断血流滴丸主要含有木犀草素(化学式为C13H2Ox)等黄酮类活性成分,具有止血、抗菌、抗炎及免疫等药理活性。已知木犀草素的相对分子质量为254,请计算:
(1) 木犀草素是由 种元素组成,x的值为 。
(2) 木犀草素中碳、氢元素的质量比为 (最简比)。
(3) 木犀草素中碳元素的质量分数是多少?(结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年12月17日中国首艘国产航母“山东舰”交付中国海军入列,开拓中国新蓝海。
(1)航母甲板上涂有耐高温、耐磨的碳化硅(SiC)涂层,碳化硅的结构类似于金刚石的结构,则构成碳化硅的粒子是__________(填“分子”“原子”或“离子”)。
(2)航母舰体材料为合金钢,国产航母使用的“超级钢”具有极佳的抗压性、延展性和焊接性。合金钢是__________(填“金属”或“合成”)材料。
(3)硝酸铵可用于制造导弹炸药,农业上还可用作__________。
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应的化学方程式为_______,该反应的基本类型为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为某化工企业生产流程示意图:
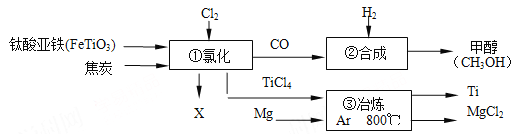
下列说法正确的是
A.钛酸亚铁(FeTiO3)中钛元素为+3价
B.①中反应为:2FeTiO3+6C+7Cl2![]() 2X+2TiCl4+6CO,则X为FeCl3
2X+2TiCl4+6CO,则X为FeCl3
C.③中氩气(Ar)作保护气,反应类型为置换反应
D.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化氢溶液在MnO2作催化剂的条件下能迅速分解生成O2和H2O,分液漏斗可以通过调节活塞控制液体的滴加速度。如下图:回答下列问题:
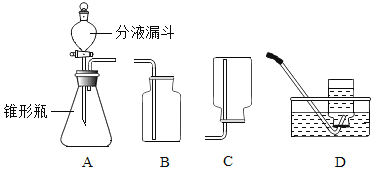
(1)分液漏斗中应放入的物质是___________,锥形瓶中应放入的物质是______________。
(2)写出该方法制取O2的化学反应方程式________________________________;要收集一瓶纯净的O2,应选择装置 ___________(填字母)。
(3)某同学在观察到锥形瓶内有大量气泡时,开始用B装置收集O2,过一段时间后用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃。其原因是_______________________________。
(4)写出用该装置制取另外2种气体的化学式:___________和___________。
(5)若实验时用此法代替KMnO4加热制取O2,优点是_______________(填编号)。
①生成物只有氧气 ②不需加热 ③需加热
(6)装置A中反应很剧烈,据此提出实验安全注意事项是_________(填编号)。
①控制液体的滴加速度 ②用体积较小的锥形瓶 ③加热反应物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于铁钉生锈的说法不正确的是( )
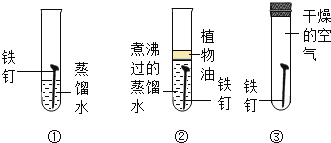
A.①中的铁钉底部生锈最严重
B.②中的蒸馏水煮沸的目的是除去水中溶解的氧气
C.②中的植物油是为了隔绝空气
D.①②③对比可探究铁的锈蚀至少与氧气和水有关
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】哈尔滨是国家历史名城,是热点旅游城市和国际冰雪文化名城,素有“冰城”、 “东方小巴黎”之称。

(1)哈尔滨是中国纬度最高、气温最低的大城市,为了保证在低温环境下作物的顺利生长,应当适量施_____________肥(填化肥种类),氮肥也是在农业生产中经常被使用的化肥,氮肥有促进植物茎、叶生长茂盛,叶色浓绿,提高植物_________________的作用。
(2)在冬季,进行燃煤供暖是保障哈尔滨市民家中温度的主要方式,将煤隔绝空气加强热,可以使煤分解成_____________、 煤焦油、煤气等。
(3)哈尔滨啤酒是中国最早的啤酒,大麦是酿酒的主要原料,大麦中所富含营养素的主要成分的化学式____________,这类营养素的主要作用是在人体内经缓慢氧化放出能量,为机体活动和____________提供能量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活离不开水,我们可以从组成、结构、性质等角度认识水。
(1)组成:下图所示电解水的实验中,试管 a、b 中产生气体的体积比约为_____,该 实验证明水是由_____组成的。
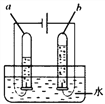
(2)结构:每个水分子是由_____构成的。
(3)性质:水能与许多物质发生化学反应,写出水与氧化钙反应的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com