
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸质量/g | 10 | 10 | 10 | 10 | 10 |
| 每次产生气体质量/g | 0.44 | 0.44 | 0.44 | 0.22 | 0 |
分析 (1)观察并对比表格中的数据可知:前三次加入10g盐酸,产生二氧化碳的质量都是0.44g,说明每10g盐酸能够生成0.44g二氧化碳,即前三次加入的稀盐酸都完全反应,可以据此解答;
(2)根据表格中的数据可以计算出二氧化碳的质量,根据化学方程式得出各物质之间的质量比,列出比例式,即可求出参加反应的CaCO3的质量,然后再根据质量分数公式进行计算即可.
(3)10g 盐酸反应能够生成0.44g气体,可以据此求出氯化氢的质量,然后完成解答即可.
解答 解:(1)观察并对比表格中的数据可知:前三次加入10g盐酸,产生二氧化碳的质量都是0.44g,说明每10g盐酸能够生成0.44g二氧化碳,即前三次加入的稀盐酸都完全反应;
(2)本次实验共成二氧化碳的质量为:0.44g×3+0.22g=1.54g
设碳酸钙的质量为x
(2)设5g石灰石中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.54g
$\frac{100}{x}$=$\frac{44}{1.54g}$
x=3.5g
石灰石样品中碳酸钙的质量分数为:$\frac{3.5g}{4.0g}$×100%=87.5%
设10g盐酸中溶质的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
y 0.44g
$\frac{73}{y}$=$\frac{44}{0.44g}$
y=0.73g
此种盐酸里的氯化氢气体的质量分数为:$\frac{0.73g}{10g}$×100%=7.3%
答:此种盐酸里的氯化氢气体的质量分数为7.3%.
故答案为:(1)1、2、3;
(2)87.5%;
(3)7.3%.
点评 本题主要考查学生对完全反应的概念的认识,以及运用化学方程式和质量分数公式进行计算的能力.


 小学教材全测系列答案
小学教材全测系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 20℃,1L水与1L酒精混合后的体积等于2L | |
| B. | 20℃,1g镁在1g氧气充分燃烧后,生成氧化镁2g | |
| C. | 20℃,1个氢分子与1个氧分子结合生成2个水分子 | |
| D. | 20℃,1g硫粉在1g氧气中完全燃烧后生成2g二氧化硫 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
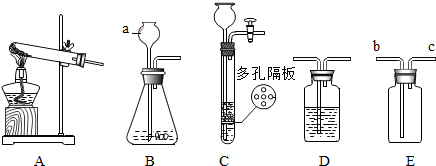 请结合下列实验常用装置,回答有关问题.
请结合下列实验常用装置,回答有关问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com