
【题目】发酵粉的主要成分中含有碳酸氢钠。某化学兴趣小组的同学对碳酸氢钠的性质进行如下探究。
Ⅰ.定性探究
实验一:探究碳酸氢钠溶液的酸碱性
(1)用pH试纸测得碳酸氢钠溶液的pH约为9,可知碳酸氢钠溶液________性。
实验二:探究碳酸氢钠的热稳定性
[查阅资料] 碳酸氢钠受热容易分解,生成水、一种气体和一种常见的固体物质。
[实验1] 如图所示,取一定量的碳酸氢钠放到铜片上加热。

(2)加热一段时间后,观察到烧杯内壁产生___________(填现象)。
(3)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是______________。
(4)欲通过实验探究进一步确定充分加热后的固体产物的成分。
猜想1:可能是NaOH;猜想2:可能是Na2CO3;猜想3:可能是NaOH和Na2CO3。
实验2:
实验操作(步骤) | 实验现象 | 实验结论 |
①将该固体溶于水配制成溶液,取少量溶液于试管中,滴加足量稀盐酸 | 有气体产生 | 猜想_______不成立 |
②另取少量溶液于试管中,滴加_____ | _____ | 固体产物中含Na2CO3 |
③取步骤②所得上层清液,滴加_____ | 无明显现象 | 猜想2成立 |
[实验结论]
(5)NaHCO3受热易分解,反应化学方程式为_________________________________________。
Ⅱ.定量探究
为测定某发酵粉中碳酸氢钠的质量分数(发酵粉中其他组分不参与反应),设计了如下实验。
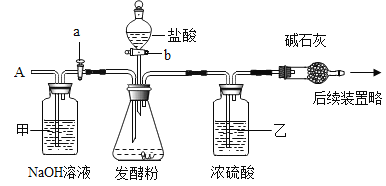
[查阅资料] 碱石灰是氧化钙和氢氧化钠固体的混合物。
[实验步骤]
①取50g样品于锥形瓶中,关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量空气;
②关闭活塞a,打开活塞b,加入足量的稀盐酸,直至锥形瓶内不再产生气泡;
③关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量空气,直至干燥管内物质质量不再增加;
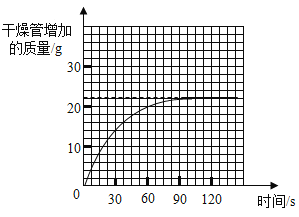
④测量干燥管增加的质量与时间关系(见曲线图)。
(1)步骤①加入样品前还应___________________。
(2)装置乙的作用是_________________________。
(3)步骤③鼓入一定量空气的目的是_________________________________。
(4)若缺少装置甲,将导致结果_________(选填“偏大”、“偏小”或“不变”)。
(5)实验测得干燥管增加的质量与时间关系(见曲线图),涉及反应的方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。请回答:
①生成二氧化碳的质量为_______g。
②该样品中碳酸氢钠的质量分数。(写出计算过程)______。
(6)[拓展应用]
①碳酸氢钠、氢氧化镁、氢氧化铝等常用于制作抗酸药,用来治疗胃酸过多。但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠,其原因是____________________。
②实验室有两瓶失去标签的固体药品,已知它们是碳酸钠和碳酸氢钠,你能否设计一个实验进行鉴别,请简述你的实验方案、现象和结论______________________________________________。
【答案】碱 水珠 二氧化碳 1 足量的氯化钡溶液 有白色沉淀生成 酚酞试液 2NaHCO3![]() Na2CO3+CO2↑+H2O 检查装置的气密性 吸收气体中的水,避免水对测定结果的影响 将二氧化碳全部赶入碱石灰中,与之充分反应 偏大 22g 84% 碳酸氢钠能和胃酸反应生成二氧化碳气体,可能引起胃穿孔,加重病情 取样,分别放入试管中加热,无明显变化的是碳酸钠,试管壁有水珠且产生的气体能使澄清石灰水变浑浊的是碳酸氢钠
Na2CO3+CO2↑+H2O 检查装置的气密性 吸收气体中的水,避免水对测定结果的影响 将二氧化碳全部赶入碱石灰中,与之充分反应 偏大 22g 84% 碳酸氢钠能和胃酸反应生成二氧化碳气体,可能引起胃穿孔,加重病情 取样,分别放入试管中加热,无明显变化的是碳酸钠,试管壁有水珠且产生的气体能使澄清石灰水变浑浊的是碳酸氢钠
【解析】
当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;根据碳酸氢钠的化学性质分析;检验生成物是NaOH还是Na2CO3,加入氯化钡溶液可以与碳酸钠反应产生沉淀的物质,据此进行分析解答.碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3,写出反应的化学方程式即可;根据反应的化学方程式结合题干提供的数据进行分析解答即可。
Ⅰ.定性探究:
(1)用pH试纸测得碳酸氢钠溶液的pH为9,大于7,显碱性;
(2)碳酸氢钠受热容易分解,生成水,所以:加热一段时间后,观察到烧杯内壁有水珠;
(3)二氧化碳能使澄清的石灰水变浑浊,说明碳酸氢钠受热能分解生成二氧化碳气体;
(4)实验2:加入盐酸有气泡产生,说明一定生成了碳酸钠,故猜想1不合理;检验生成物是NaOH还是Na2CO3,加入足量的氯化钡(或氯化钙)溶液可以与碳酸钠溶液反应产生白色沉淀,若有白色沉淀生成,说明固体产物是Na2CO3,取反应后的上层清液,向其中滴加酚酞试液,酚酞试液不变红,说明溶液中不含氢氧根,说明固体产物中不含氢氧化钠,即猜想2成立;
(5)碳酸氢钠受热容易分解,生成水、二氧化碳气体和Na2CO3,反应的化学方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
Ⅱ.定量探究:
(1)步骤①加入样品前还应检查装置的气密性;
(2)装置乙:浓硫酸具有吸水性,混合气体通过浓硫酸时,硫酸吸收气体中的水,避免水对测定结果的影响;
(3)步骤③鼓入一定量空气后,可以将发酵粉和盐酸反应生成的二氧化碳全部赶入碱石灰中,与之充分反应;
(4)装置甲:空气中的二氧化碳能被NaOH溶液吸收,通过NaOH溶液后的空气中不再含有二氧化碳,避免了空气中二氧化碳对测定结果的影响,防止测定的数据偏大;
(5)分析坐标图可知:干燥管中增加的质量为22g,则生成的二氧化碳的质量为22g;设样品中碳酸氢钠的质量为x,

![]()
x=42g,
该样品中碳酸氢钠的质量分数=![]() ×100%=84%;
×100%=84%;
(6)[拓展应用]
①碳酸氢钠与酸反应能生成二氧化碳气体,生成的二氧化碳使胃中气压增大,可能引起胃穿孔,加重病情;
②碳酸钠受热不分解,碳酸氢钠受热易分解,故可以取样加热,观察现象,方案为:取样,分别放入试管中加热,无明显变化的是碳酸钠,试管壁有水珠且产生的气体能使澄清石灰水变浑浊的是碳酸氢钠。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:初中化学 来源: 题型:
【题目】夏飞同学想要用含有杂质二氧化碳、氢气和水蒸气的一氧化碳气体测定mg样品中氧化铁的质量分数。装置如图所示,连接实验装置后先通一段时间氮气,再继续实验(已知试剂均足量,样品中的杂质不参与反应也不挥发)。下列说法正确的是( )
①装置甲、乙、丁中的试剂分别是浓硫酸、氢氧化钠溶液、澄清石灰水; ②实验时先点燃丙、戊处的酒精灯,过一会再通入混合气体; ③该实验既可验证一氧化碳的还原性,又可验证一氧化碳的可燃性; ④实验中会观察到甲、丁中液体均变浑浊; ⑤实验结束后称量丙中固体质量为ng,则样品中氧化铁的质量分数为10(m-n)/3m×100﹪ ⑥利用丁装置在反应前后改变的质量也能计算出氧化铁的质量分数
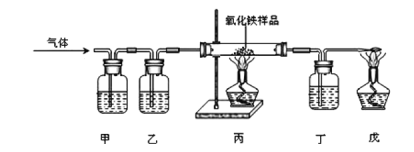
A. ①②③⑤B. ②③⑤C. ②③④⑤D. ③④⑤⑥
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活息息相关。请根据下列情况回答问题:
(1)下图是简易净水装置,a小卵石、b活性炭、c石英沙这三种材料放置在装置相应的位置以获得较好的净水效果,则图中的①②③依次为__________。(填序号)

(2)金属材料在实际生活中应用非常广泛,下列物品中不能用钛合金制作的是_______(填写序号)A.医疗器械 B.保险丝 C.潜艇外壳 D.眼镜架
(3)铁在潮湿的空气中容易生锈,在表面涂上一层油漆,可以延缓锈蚀,其防锈的原理是_____________。
(4)冬天室内取暖时,燃烧木炭时会出现火焰,原因是___________。
(5)书写重要文档时,常会使用碳素墨水,主要原因是__________。
(6)高层建筑着火时,常会使用高压水枪进行灭火,水的作用是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用下列装置来制取氧气:
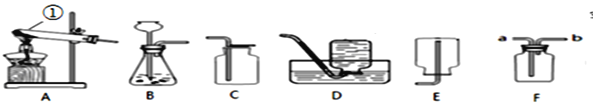
(1)写出仪器①的名称___________。
(2)用过氧化氢和二氧化锰来制取氧气时,可选用的发生装置是______(填序号),反应的文字或符号表达式:_________________________.该反应类型属于___________反应:
(3)实验室用高锰酸钾制取氧气,反应的文字或符号表达式:______________________________________.可选用的发生装置是________。在加入药品之前应对实验装置进行___________________,
若选用D装置收集氧气时,下列实验操作不正确的是______(填序号).
a.加热前,将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中
b.加热后,观察到水中导管口开始有气泡时,立即收集气体
c.待集气瓶里的水排完后,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上
d、实验结束后,先停止加热,后从水槽中取出导气管
实验过程中小明同学观察到装置的中的水变为红色,这是因为_______________的缘故.
(4)用C装置收集氧气的依据是______________________,这种收集方法检验氧气是否集满的方法是__________________________________________。
(5)F图是化学中的多功能瓶,可以有如下用途:
①可以用做向上排空气法收集氧气,从__________端进氧气。
②医院里给病人输氧为了给氧气加湿和观察氧气的输出速度也可以在氧气瓶和病人之间连接该装置,在集气瓶装半瓶水,将___________端接氧气钢瓶。
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水,其水溶液呈碱性。
制取并收集NH3,应该从上图中选择的发生装置是_____________,收集装置是______ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是日常生活中常用的几种清洗剂,请回答:
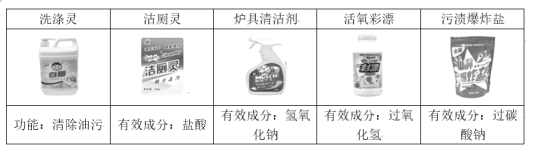
(1)清除以下物质,可使用炉具清洁剂的是_______(填标号)。
a 铁锈 b 油污 c 水垢
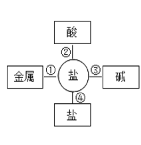
(2)污渍爆炸盐溶于水后生成Na2CO3和H2O2,再加入足量洁厕灵,产生能使澄清石灰水变浑浊的气体。产生该气体的反应体现了下图中________(选填“①”、“②”、“③”或“④”)的性质关系。
(3)如下图甲所示,将洁厕灵滴入炉具清洁剂中。
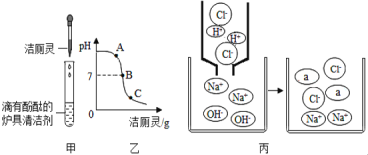
①发生反应的化学方程式为_________________________________________________________,该反应属于_______________(填基本反应类型)。
②若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)_______________,此时溶液可用图乙中__________(选填“A”、“B”或“C”)点处表示。
③若反应后溶液pH为7,图丙中a微粒的化学式为__________。
④下列试剂不能验证出反应后溶液处于图乙中C点的是________(填标号)。
a pH试纸 b 铜粉 c 氧化铁 d 氢氧化铜 e 碳酸钙 f 硝酸银溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂化验室用稀硫酸处理造纸厂产生含有氢氧化钠的废水.现称取废水样品80g倒入烧杯中,逐滴加入10%的稀硫酸至恰好完全反应,消耗稀硫酸98g。
(反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O)[]
(1)氢氧化钠中氧元素的质量分数是 ;
(2)求废水中氢氧化钠的质量分数(要写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示A~G是初中化学中常见的物质(反应条件和部分产物已省略,“—”表示相互能反应,“→”表示转化关系),其中A是人体胃液中含有的酸,B与C的组成元素相同,D是一种红色粉末,F是相对分子质量最小的氧化物.请回答下列问题.

(1)写出物质E的一种用途:_______;
(2)A~G七种物质中,氧化物有_______种;
(3)F→E的反应现象是______________;
(4)C﹣D反应的化学方程式是:______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】热水瓶用久后,瓶胆内壁常附着一层水垢,其成份是碳酸钙、氢氧化镁及少量水。实验室现有一瓶水垢样品,为测定其中各成份的质量分数,某化学兴趣小组的同学利用下图所示装置进行实验。
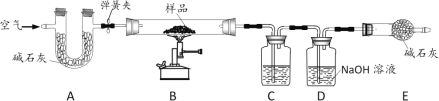
已知:
①装置气密性完好,A、C、D中所装药品均为足量;
②碱石灰是氧化钙和氢氧化钠的固体混合物;
③在加热条件下,氢氧化镁易分解成两种氧化物。
主要实验步骤如下:
I.将质量为12.0g的样品装入装置B的玻璃管中,连接装置,关闭弹簧夹,加热;
II.待样品完全反应,先 ____(选填“打开弹簧夹缓缓通入空气”或“熄灭酒精喷灯”);
III.实验完毕,测得装置C、D中质量分别增加了2.5g、3.3g;
IV.根据实验所测数据计算该样品中碳酸钙、氢氧化镁和水的质量分数。
请回答下列问题:
(1)装置C中所装药品为_____。
(2)装置D中发生反应的化学方程式为_____。
(3)该水垢样品中碳酸钙的质量分数为_____。
(4)装置E的作用为_____。
(5)实验反思:实验步骤不变,若没有装置A,会导致碳酸钙的测定结果_____(填“偏大”、“偏小”或“无法判断”,下同) ;若没有装置E,会导致氢氧化镁的测定结果 ____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属及金属材料在生产、生活中应用广泛。

(1)生活中使用的铜火锅是利用铜的______性。
(2)铁制品锈蚀主要是铁与______作用的结果,在空气中易生锈,生活中防盗门的防锈常采用的方法是______。
(3)为验证铁和铜的金属活动性顺序,小明设计了如图所示的实验。能说明铁比铜金属活动性强的实验现象是______;小亮选择了铁片和______(填一种试剂)也得出同样的结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com