
| A. | 硫酸、氢氧化钙、食盐 | B. | 硫酸、食盐、氢氧化钙 | ||
| C. | 氢氧化钙、硫酸、食盐 | D. | 氢氧化钙、食盐、硫酸 |
科目:初中化学 来源: 题型:选择题
| A. | 蛋白质 | B. | 油脂 | C. | 维生素 | D. | 无机盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 浓度时间催化剂 | 30%H2O2溶液 | 15% H2O2溶液 | 5% H2O2溶液 |
| 加入WgMnO2 | 0.2 | 0.8 | 2.0 |
| 加入WgFe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
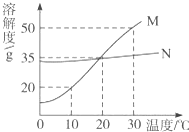 固体物质的溶解性与溶解度之间的关系如下表所示:
固体物质的溶解性与溶解度之间的关系如下表所示:| 20℃时溶解度/g | >10 | 10-1 | 1-0.01 | <0.01 |
| 溶解性 | 易溶 | 可溶 | 微溶 | 难溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
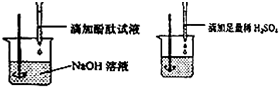
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL,滴加几滴紫色石蕊试液 0,振荡 | 石蕊试液变成红色等 | 溶液呈酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com