
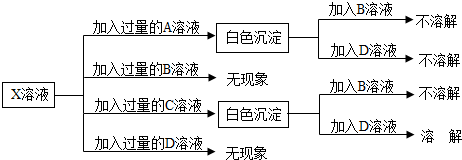
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
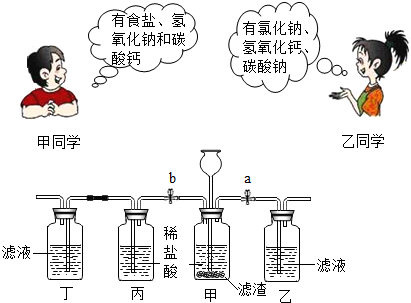
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
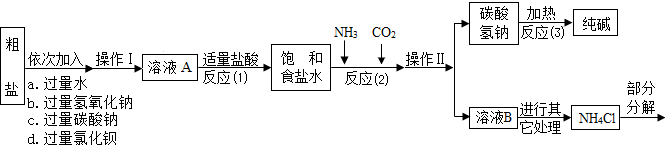
| ||
| ||
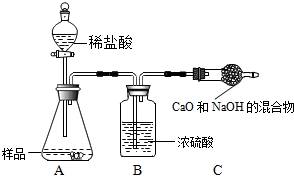
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
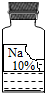 (2013?鹤壁二模)实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:
(2013?鹤壁二模)实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 盐酸 盐酸 |
产生大量的气泡 | 该溶液是 Na2CO3 Na2CO3 |

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
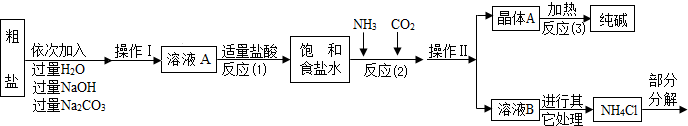
| ||
| ||
| 选择的装置 | 实验现象 | 实验结论 |
AB”或“AC”或“ACB AB”或“AC”或“ACB |
“B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” “B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” |
样品不含晶体A |
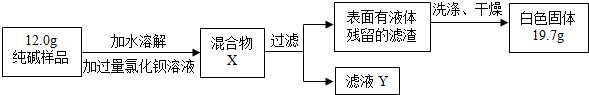
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com