
| A. | 用过滤的方法可以使硬水软化 | |
| B. | 用活性炭吸附水中的色素和异味是化学变化 | |
| C. | 水通电分解时产生的氢气和氧气质量比为2:1 | |
| D. | 可用肥皂水区分硬水与软水 |
 全程金卷系列答案
全程金卷系列答案科目:初中化学 来源: 题型:实验探究题
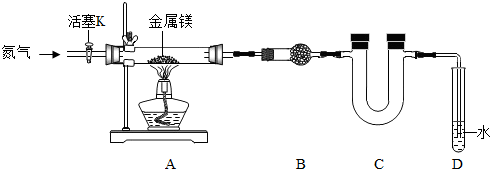
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | N2O | B. | NO2 | C. | N2O | D. | N2O5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 奶类、虾皮、豆类中含有丰富的人体所需的钙元素 | |
| B. | 铁、碘、氟、钠、硒是人体所需的微量元素 | |
| C. | 除水外,我们每天需要量最大的营养素是糖类 | |
| D. | 人体内碘元素缺乏或过量都会引起甲状腺肿大 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | CO | 点燃 |
| B | NaOH溶液 | Na2CO3溶液 | 加入适量稀盐酸 |
| C | 铜粉 | 铁粉 | 加入过量的稀硫酸,过滤 |
| D | CaO | CaCO3 | 加水,溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
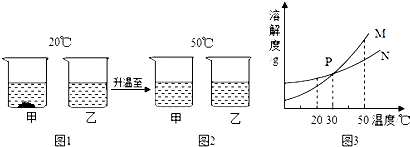
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
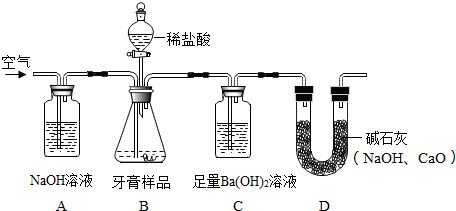
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com