
t2℃时,向盛有10g水的烧杯中加入13g固体甲,搅拌后固体完全溶解,放置一段时间后,溶液中固体析出,甲的溶解度曲线如图所示。下列说法正确的是

A. 图中P点表示甲的溶解度为98g
B. 搅拌的目的是増大甲的溶解度
C. 通过升温可以将甲的不饱和容易变为饱和溶液
D. 甲溶于水的过程中一定放出热量
D 【解析】A、溶解度受温度影响,表述溶解度时要指明温度,图中P点表示在t1℃时,甲的溶解度,错误;B、搅拌的目的是加速溶解,并不能改变物质的溶解度,错误;C、甲物质的溶解度随温度升高而升高,因此升温时甲的溶液能够溶解更多的甲物质,不能变成饱和溶液,错误;D、甲物质的溶解度随温度升高而升高,根据题意,t2℃时,加的溶解度是110 g,向10g水中加入13g甲物质完全溶解,当一段时间后,有固体... 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:初中化学 来源:湖南省长沙市2018年中考理科综合试卷化学试卷 题型:单选题
燃烧是人类最早利用的化学变化之一,运用燃烧和灭火的知识是同学们应该具备的基本科学素养,下列灭火的措施或行为你认为错误的是( )
A. 炒菜时油锅着火,用锅盖盖灭
B. 电烤炉着火时,用水浇灭
C. 堆放杂物的纸箱着火时,用水浇灭
D. 不慎碰倒酒精灯,洒出的酒精在桌上燃烧起来,立即用湿抹布扑盖
B 【解析】A、炒菜时油锅里的油着火时,可用锅盖盖灭,属于隔绝氧气灭火,正确;B、电烤炉着火时,用水浇,容易造成安全事故,要先切断电源,再灭火,错误;C、水汽化吸热能降低温度到可燃物的着火点以下,堆放杂物的纸箱着火时,可用水浇灭,正确;D、用湿抹布盖上时,能使酒精和氧气隔绝,实现灭火,正确。故选B。查看答案和解析>>
科目:初中化学 来源:山东省2018届九年级下学期模拟测试化学试卷 题型:单选题
归纳和类推是化学学习的常用方法,下列说法正确的是( )
A. 盐酸与硫酸化学性质相似,是由于在水溶液中都解离出H+
B. 盐中含有金属离子和酸根离子,NH4NO3中没有金属离子,不属于盐
C. 碳酸盐和酸反应会放出气体,能与酸反应放出气体的物质一定是碳酸盐
D. 中和反应有盐和水生成,生成盐和水的反应一定是中和反应
A 【解析】A、盐酸与硫酸化学性质相似,是由于在水溶液中都解离出H+,故A正确;B、盐中含有金属离子和酸根离子,NH4NO3中没有金属离子,属于盐,铵根离子与金属离子具有相似的性质,故B错误;C、碳酸盐和酸反应会放出气体,能与酸反应放出气体的物质不一定是碳酸盐,也可能活泼金属,故C错误;D、中和反应有盐和水生成,生成盐和水的反应不一定是中和反应,中和反应的反应物是酸和碱,故D错误。 点...查看答案和解析>>
科目:初中化学 来源:江西省2018年中考化学试卷 题型:科学探究题
兴趣小组的利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液。探究酸碱盐的性质。小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]刺激性气味的气体是什么?
[猜想与假设]猜想1.可能是二氧化硫 猜想2.可能是氯化氢
猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是_____________________。
[查阅资料] SO2和CO2的化学性质相似,都能使澄清灰水变浑浊。写出二氧化硫和氢氧化钙的反应的化学方程式:____________________________。
[实验探究]如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到_________,于是他认为猜想2正确。
[评价与改进]小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确。
实验操作 | 实验现象 |
如图所示,将产生的气体________________ | _____________________ |
[结论]加热氯化钠与硫酸的混合溶液得到的气体是氯化氢
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水。请推测实验室制取氯化氢气体最适宜的方法为________________(填序号)。
A.加热氯化钠溶液和稀硫酸的混合物 B.加热氯化钠固体和稀硫酸的混合物
C.加热氯化钠固体和浓硫酸的混合物
反应物中没有氮元素,所以无法生成氨气 SO2+Ca(OH)2=CaSO3↓+H2O 溶液变红 通入澄清石灰水中 无明显现象 C 【解析】[猜想与假设]根据质量守恒定律可知,反应前后元素的种类不变,反应物中没有氮元素,所以无法生成氨气; [查阅资料]SO2和CO2的化学性质相似,都能使澄清灰水变浑浊。二氧化硫和氢氧化钙的反应生成亚硫酸钙和水,化学方程式为SO2+Ca(OH)2=CaSO...查看答案和解析>>
科目:初中化学 来源:江西省2018年中考化学试卷 题型:选择填充题
下列图像能符合题意反映对应变化关系的是________;
A.  加热等质量的氯酸钾
加热等质量的氯酸钾
B.  通电分解水
通电分解水
C.  向一定量的氢氧化钠溶液中逐渐加入稀盐酸
向一定量的氢氧化钠溶液中逐渐加入稀盐酸
D.  将一定量含有盐酸的氯化钙溶液中逐渐加入碳酸钾溶液,则图中物质R是________。
将一定量含有盐酸的氯化钙溶液中逐渐加入碳酸钾溶液,则图中物质R是________。
查看答案和解析>>
科目:初中化学 来源:江西省2018年中考化学试卷 题型:单选题
氧气在降温加压变成液态氧的过程中,下列说法正确的是( )
A. 分子之间的间隔变小 B. 分子质量变小
C. 分子体积变大 D. 分子运动速率变大
A 【解析】 氧气由气态变为液态,只是状态发生了变化,变化的是分子之间的间隔,分子之间的间隔变小,分子的质量不变,分子的体积不变,分子运动速率减慢。故选A。查看答案和解析>>
科目:初中化学 来源:四川省南充市2018年中考化学试卷 题型:科学探究题
阅读下面科普短文(有刪改)
火炸药的绿色制造技术发展
以硝基化合物为代表的含能材料是火炸药技术的基础,其传统的制造工艺过程会产生含有大量有机物的废酸和废水,环境污染严重,治理费用高,因此火炸药原材料组分传统制造工艺需要进行绿色化和低成本改进,以及积极开发含能材料的绿色合成工艺。
硝基含能化合物的生物合成是火炸药原材料制造技术中最新颖的前沿研究领域,是一种真正绿色合成路线。最具代表性的新型硝化技术是用N2O5作为绿色硝化剂,这一技术的关键是如何制备N2O5和怎样实现N2O5硝化工艺。
研究的N2O5制备方法主要有半渗透膜电解法和臭氧氧化法:1)半渗透膜电解法是在电解池内用特制的半渗透膜隔开两个电极,电解无水硝酸而生成N2O5;2)臭氧氧化法是将浓度5%~10%的臭氧与氧气的混合物和N2O4进行气相反应生成N2O5。
试验的N2O5硝化工艺主要有2种:1)用N2O5-HNO3-N2O4作硝化剂进行硝化;2)用N2O5和无水HNO3于液态二氧化碳中进行硝化。
南京理工大学研究了用DADN原料在N2O5-HNO3体系中绿色硝解制备HMX。以DADN为原料,不同硝解方法的优缺点比较见下表:
硝化体系 | 收率/% | 优点 | 缺点 |
HNO3 | 40 | 步骤简单 | 得率低 |
H2SO4、NH4NO3、HNO3 | 80-85 | 工艺成熟 | 废酸量大,难处理 |
P2O3-HNO3 | 99 | 得率高,纯度好 | P2O3和HNO3需大大过量,腐蚀性大 |
N2O5-有机溶剂 | 65 | 无需废酸处理 | 得率低,溶剂易挥发 |
N2O5-HNO3 | 94 | 得率高,废酸少,硝化剂的过量比小 | 无 |
火炸药的安全使用知识有:防止炸药受热、火焰引起的爆炸;按炸药使用温度使用,不 要超过温度条件;禁止长时间阳光照射;禁止电焊、气焊、气割作业等。
依据文章内容,回答下列问题:
(1)文中涉及到的下列物质:P2O5、HNO3、O3、NH4NO3、N2O4中,不包括的物质类别是______________ (填序号)。
A.单质 B.氧化物 C.酸 D.碱 E.盐
(2)最具代表性的新型硝化技术是用_____________作为绿色硝化剂。
(3)上表中,以DADN为原料,不同硝解方法比较中,P2O3和HNO3需大大过量,腐蚀性大的硝化体系是__________________。
(4)火炸药的安全使用还有哪些注意事项___________________。 (原文已有方法不能重复,任答一点)
D N2O5 P2O3-HNO3 远离烟火等 【解析】(1)根据物质所属类别解答;(2)根据题中信息解答;(3)根据题中信息解答;(4)根据已有知识解答。(1)文中涉及到的下列物质:P2O5(氧化物)、HNO3(酸)、O3(单质)、NH4NO3(盐)、N2O4(氧化物)中,不包括的物质类别是碱,故选D;(2)由题中信息可知,最具代表性的新型硝化技术是用N2O5作为绿色硝化剂;(3)由表中可知...查看答案和解析>>
科目:初中化学 来源:山东省济宁市2018年中考化学试卷 题型:科学探究题
(1)某研究性学习小组为验证“氨气还原氧化铜”的实验,认真查阅资料并做出以下准备。
资科准备:
I.氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,溶液呈碱性。
II.氢气还原氧化铜的化学反应原理2NH3+3CuO 3Cu+N2+3H2O
3Cu+N2+3H2O
实验准备:

请回答:
①为达成“氨气还原氧化铜”的实验目的,装置A、B、D、E的正确连接顺序________ (填序号);
②装置A中发生反应的化学方程式_____________;
③装置B观察到的现象________,装置E的作用_____________;
④装置A产生的气体通人装置C中,石蕊试液浸泡的纸花变监色,原因是________。
(2)小凡同学利用氯化钡和氢氧化钠两种试剂,从硫酸钠、硫酸镁和氯化镁三瓶未贴标签的无色溶液中鉴别出硫酸镁溶液,设计并进行以下实验。请你补齐实验内容:
实验步骤 | 实验现象 | 实验结论 |
1.取三支持净试管,分别倒入三种无色溶液,然后滴加 _________,振荡,观察现象; | ______________ | ______________ |
2. ______________ | ______________ | ______________ |
查看答案和解析>>
科目:初中化学 来源:浙江省嘉兴市2018年中考化学试卷 题型:计算题
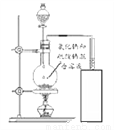
大理石是含杂质的碳酸钙,因具有美丽花纹面被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。
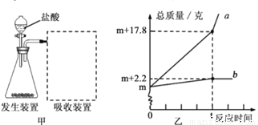
(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是_______________。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克,实验后,根据实验数据绘了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量______________。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数为___________。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大,会对实验结果造成较大影响,其原因是______________。
硫酸与碳酸钙反应生成的硫酸钙微溶于水、它会包裏在大理石表面,使酸溶液不能与大理石接触.从而使反应中止 碳酸钙的质量是5克 盐酸的貭量分数是18.25% 盐酸浓度越大,挥发性越强,会挥发出更多的氯化氢气体被吸收装置吸收,导致二氧化碳測量值偏大,对结果有较大影响 【解析】 (1)制取二氧化碳时,常用石灰石或大理石和稀盐酸,不用硫酸的原因是:硫酸与碳酸钙反应生成的硫酸钙微溶于水、它会包裏在大...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com