
实验室用100 g含杂质15%的大理石,最多可制得多少二氧化碳?
|
答:最多可制得二氧化碳37.4 g 解:设最多可制得二氧化碳的质量为x 由题意:纯净的CaCO3的质量为100 g×(1-15%)=85 g CaCO3 100 44 85 g x 100/85 g=44/x x=37.4 g 解析:由于化学方程式所表示的各物质之间的质量比是纯净物的质量比,不纯物质的质量不能直接用来根据化学方程式计算. (1)若已知物不纯,需先算出其中纯净物的质量:纯物质质量=不纯物质质量×纯物质质量分数=不纯物质量×(1-杂质质量分数),然后用纯物质质量根据化学方程式求出待求物质量. (2)若待求物不纯,需先根据方程式算出待求物中纯物质的质量,再求得待求物(不纯物)的质量. |


科目:初中化学 来源: 题型:
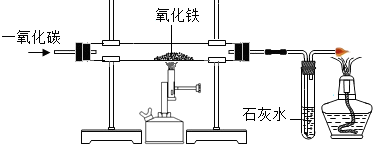
 工业上用铁矿石冶炼铁,他们在实验室用CO还原氧化铁,实验如图所示
工业上用铁矿石冶炼铁,他们在实验室用CO还原氧化铁,实验如图所示| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品的质量/g | 166.5 | 166.3 | 166.1 | 166.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g?cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
| ||
| ||
| ||
| ||
| ||
| 64×2 |
| 64×2+32 |
| 64×2 |
| 64×2+32 |
查看答案和解析>>
科目:初中化学 来源:新教材完全解读 九年级化学 (下册) (人教版) 人教版 题型:022
在实验室配制溶液时,常涉及下列过程:①称量、量取;②过滤;③蒸发结晶、干燥;④计算;⑤溶解.
请按要求回答下列问题:
(1)甲同学用氯化钠和蒸馏水配制50 g 5%的氯化钠溶液,正确的操作顺序是________(用序号排列).实验室中有10 mL,50 mL,100 mL等不同规格的量筒,配制该溶液时最好选用________mL的量筒.
(2)乙同学用10 g含杂质10%的食盐(杂质不溶于水)和蒸馏水配制50 g 5%的氯化钠溶液,正确的操作顺序是________(用序号排列).
查看答案和解析>>
科目:初中化学 来源: 题型:
某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析。他们分别用100 g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表。
| 实验次数 | 1 | 2 | 3 |
| 加入 | 4 | 8 | 12 |
| 充分反应后剩余 物质的总质量(g) | 103.9 | 107.8 | 111.8 |
请回答下列问题:
(1)第 次实验,锌粒与稀硫酸恰好完全反应。
(2)计算该稀硫酸样品的溶质质量分数(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com