
| 实验序号 | 第一次 | 第二次 | 第三次 |
| 氧气的质量 | 7g | 8g | 10g |
| 生成SO2的质量 | 14g | 16g | 16g |
分析 根据质量守恒定律,若第一次实验8g硫与7g氧气反应,应生成二氧化硫质量=8g+7g=15g,而实际反应中只生成二氧化硫14g<15g说明两种物质未恰好完全反应,有一种物质有剩余;第二次实验8g硫与8g氧气与生成的16g二氧化硫,质量关系恰好与质量守恒定律相符,说明此时反应为恰好完全反应;则第三次实验中氧气质量再增加至10g,因硫不足而氧气剩余进行分析.
解答 解:(1)参加反应的各物质质量总与反应生成物质质量总和相等,符合这一要求的只有第二次实验,所以第二次实验中两种物质恰好完全反应;
(2)由于第二次实验中氧气时8g时,恰好完全反应,第一次实验中氧气只有7g不足8g,所以硫会有剩余,剩余硫的质量=8g-7g=1g;
(3)只要发生化学变化,就符合质量守恒定律.
故答案为:(1)二;(2)一,1;(3)没有.
点评 根据质量守恒定律,反应物质恰好完全反应,参加反应的反应物质质量总和一定等于生成物质量总和即可正确解答.


 阶梯计算系列答案
阶梯计算系列答案科目:初中化学 来源: 题型:填空题
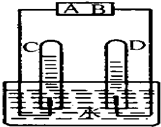 如图是电解水的简易装置
如图是电解水的简易装置查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaCl2 KNO3 Na2CO3 KCl | B. | NaCl BaCl2 Na2CO3 HCl | ||
| C. | Na2SO4 Ba(OH)2 Na2CO3 NaNO3 | D. | HNO3 Na2CO3 MgCl2 Ba(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应物均是单质 | B. | 生成物均是氧化物 | ||
| C. | 生成物均是气体 | D. | 反应时均产生蓝色火焰 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

 ”和“
”和“ ”分别表示不同的原子).
”分别表示不同的原子).
 ”微粒.
”微粒.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
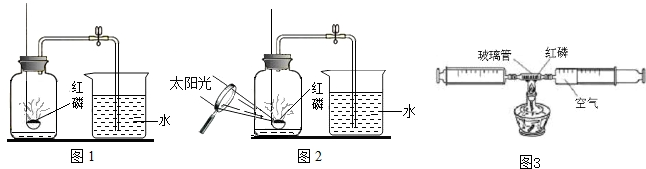
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com