
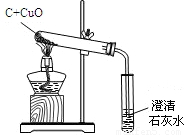
 2Cu+CO2↑;
2Cu+CO2↑; 2Cu+CO2↑;
2Cu+CO2↑;

科目:初中化学 来源: 题型:


| pH | 水的应用 |
| 10.0 | 浸泡蔬菜 |
| 9.5 | 日常饮用 |
| 9.0 | 烹饪 |
| 6.0 | 洗头发 |
| 5.5 | 洗涤器皿 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| 1 |
| 5 |
| 1 |
| 5 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2010?密云县一模)水是生命之源,2010 年世界水日的主题是“关注水质、抓住机遇、应对挑战”.
(2010?密云县一模)水是生命之源,2010 年世界水日的主题是“关注水质、抓住机遇、应对挑战”.
| ||
| ||
| pH | 水的应用 |
| 10.0 | 浸泡蔬菜 |
| 9.5 | 日常饮用 |
| 9.0 | 烹饪 |
| 6.0 | 洗头发 |
| 5.5 | 洗涤器皿 |

查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)燃料的燃烧在人类社会的发展过程中起着相当重要的作用.从环境保护的角度考虑,在煤气、沼气和氢气中,首选的燃料是
(1)燃料的燃烧在人类社会的发展过程中起着相当重要的作用.从环境保护的角度考虑,在煤气、沼气和氢气中,首选的燃料是
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
下图是实验室制取气体的一些装置,据图回答有关问题。(友情提示:以下所选装置
均填装置序号)
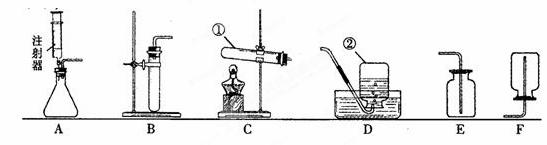 (1)写出指定仪器的名称:① ;② ;
(1)写出指定仪器的名称:① ;② ;
(2)实验室要用过氧化氢溶液和二氧化锰混合制氧气,若用A装置作氧气的发生装置,
注射器中应放入的物质是_______,锥形瓶中应放人的物质是______。
该反应的化学方程式为_______________。用A作发生装置,比起
B装置具有的主要优点是__________。
(3)若实验室要用氯酸钾和二氧化锰混合为原料用装置C制氧气,该反应的化学方程式
为__________。该装置中试管口略向下倾斜的原因是________;
要收集一瓶干燥的氧气,应选择装置______(填字母)。
⑷ 实验室在常温下用块状固体电石与水反应制取乙炔气体,该反应必须严格控制加水
速率,以免剧烈反应放热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发
生装置是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com