
| 实验序号 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
| 反应后烧杯中剩余物质的质量/g | 37.8 | 55.6 | 74.5 | 94.5 |
分析 (1)跟据质量守恒定律可知反应前后物质的减少量即为生成的二氧化碳总质量;
(2)根据第三次反应后的质量与第四次反应的质量之差可以看出,第四次加入的盐酸没有参与反应,所以可得10g样品中的碳酸钠与盐酸能够生成二氧化碳的质量,依据方程式可求出碳酸钠的质量,从而计算出样品中氯化钠的质量分数;
(3)可以根据第一次反应时生成的二氧化碳的质量求出反应的盐酸的质量分数;
解答 解:(1)由质量守恒定律可知生成的二氧化碳质量是20g+80g-94.5g=5.5g.
(2)根据第三次反应后的质量与第四次反应的质量之差可以看出,第四次加入的盐酸没有参与反应,所以可得20g样品中的碳酸钠与盐酸能够生成二氧化碳的质量是5.5g;
设20g样品中含有的碳酸钠质量是x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
x 5.5g
$\frac{106}{44}=\frac{x}{5.5g}$
x=13.25
所以样品中氯化钠的质量是20g-13.25g=6.75g,则样品中氯化钠的纯度为$\frac{6.75g}{20g}$×100%=33.75%.
(3)解:第一次实验时,生成二氧化碳的质量是20g+20g-37.8g=2.2g,设20g的稀盐酸中溶质的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
73 44
y 2.2g
$\frac{73}{44}=\frac{y}{2.2g}$
x=3.65g
稀盐酸中溶质的质量分数为:$\frac{3.65g}{20g}$×100%=18.25%
答:(1)产生CO2气体的总质量是5.5g.
(2)样品中氯化钠的纯度为33.75%.
(3)使用的稀盐酸的溶质质量分数为18.25%.
点评 根据质量守恒定律,分析四次实验的数据得出所放出二氧化碳的质量,此为进行计算的基础,更体现出对实验的分析与数据处理的能力.


科目:初中化学 来源: 题型:推断题
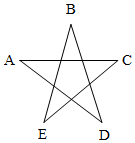 A、B、C、D、E五种物质均为初中化学中常见的化合物,它们之间的反应关系如图所示(两者间连线表示能发生反应).A、C、E均为氧化物,且A、C均常用于灭火,B是人体中胃液的成分,可用于除铁锈,而D溶液可以用来检验A;C和E反应能生成D.
A、B、C、D、E五种物质均为初中化学中常见的化合物,它们之间的反应关系如图所示(两者间连线表示能发生反应).A、C、E均为氧化物,且A、C均常用于灭火,B是人体中胃液的成分,可用于除铁锈,而D溶液可以用来检验A;C和E反应能生成D.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
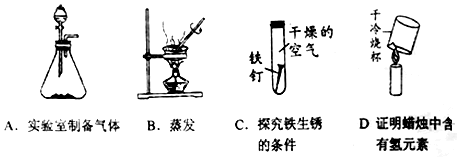
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
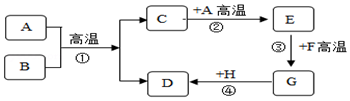
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com