某同学对一瓶失去标签的溶液进行鉴定,并测定其溶质的质量分数,他进行了如下实验:
(1)取少量该溶液,倒入一洁净的试管中,加入少量稀硫酸和稀硝酸的混合溶液出现白色沉淀,他由此得出的结论是原溶液中含有 离子;
(2)从试剂瓶中取5克溶液,倒入一洁净的烧杯里,加入0.5毫升的稀硝酸,然后用滴管滴入AgNO3溶液,出现白色沉淀.他由此得出的结论是原溶液是 溶液,继续滴加AgNO3溶液至不再生成沉淀为止;
(3)将(2)中得到的液体用玻璃棒引流进行过滤,在此玻璃棒的作用是 ;
(4)将(3)中得到的沉淀物取出充分干燥后称量其质量为0.1克,若沉淀的相对分子质量为n,原溶液中溶质的相对分子质量为m,则原溶液中的溶质质量分数为 ;
(5)在上述实验中,有一处错误操作是 .这一错误操作对所测溶液的溶质质量分数的影响是 .
【答案】
分析:(1)不溶于稀硝酸的沉淀有氯化银和硫酸钡;
(2)结合上题中分析得出的离子来确定物质;
(3)过滤时要用玻璃棒引流;
(4)根据化学方程式进行计算,要注意化学方程式的配平;
(5)过滤时,滤出的沉淀应洗涤,因为沉淀会粘有杂质,会使测定数据不准确.
解答:解:(1)加入稀硫酸和稀硝酸的混合溶液后出现沉淀,说明该沉淀为硫酸钡,进而断定原溶液中含有Ba
2+.
故答案为:Ba
2+
(2)加入稀硝酸和硝酸银溶液后,出现白色沉淀,说明该沉淀为氯化银,进而断定原溶液中含有氯离子,综合以上分析可知原溶液中含有氯化钡溶液.
故答案为:BaCl
2
(3)在过滤操作中,玻璃棒的作用是引流.
故答案为:引流
(4)设原溶液中氯化钡的质量分数为x,
BaCl
2+2AgNO
3=2AgCl↓+Ba(NO
3)
2
m2n
5g×x 0.1g

=

x=

%
∴原溶液中溶质的质量分数为
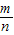
%.
(5)上述实验中,错误操作是沉淀未经洗涤,这一错误操作的影响是沉淀粘有的杂质使测定的质量分数比实际值偏大.
故答案为:沉淀未经洗涤;沉淀粘有的杂质使测定的质量分数比实际值偏大.
点评:本题考查离子的鉴定方法,同时结合化学反应进行溶质质量分数的考查,要求我们能熟练利用盐的性质进行分析和计算.

 =
=
 %
%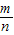 %.
%.
