
| 实验方法 | 实验现象 |
| 实验方法 | 实验现象 |
| 做纯铁丝或钢丝在纯氧气中燃烧实验 | 没有火星四射现象或火星四射现象不明显 |
| 做木炭在纯氧气中燃烧实验或做将铁丝烧在木炭上在纯氧气中燃烧实验 | 有火星四射现象 |


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
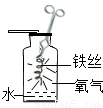
 23、如图所示的是铁丝在氧气中燃烧的实验,但李阳同学在实验过程中没有见到火星四射的现象.于是李阳准备对此问题产生的原因进行探究.
23、如图所示的是铁丝在氧气中燃烧的实验,但李阳同学在实验过程中没有见到火星四射的现象.于是李阳准备对此问题产生的原因进行探究.| 实验方法 | 实验现象 |
将纯铁丝绕成螺旋状,放在纯氧里燃烧 |
铁丝发红,火星四射现象不明显 |
| 做木炭在纯氧气中燃烧实验或做将铁丝绕在木炭上在纯氧气中燃烧实验 | 有火星四射现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2013?北京)水是最普通、最常见的物质之一.
(2013?北京)水是最普通、最常见的物质之一.
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验内容 | 实验装置 | 过程与分析 | ||||||||
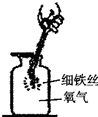
| 铁丝在纯氧中燃烧 |  |
如图所示,点燃火柴后立即连同铁丝快速深入集气瓶中下部(未接触水),但铁丝未燃烧,针对上述操作,请提出一条改进建议 待火柴快燃尽时,在将铁丝伸入集气瓶. 待火柴快燃尽时,在将铁丝伸入集气瓶. . | ||||||||
| 测定空气中O2的含量 |  |
①用聚光镜引燃白磷后夹紧弹簧夹. ②反应停止冷却至室温,打开弹簧夹,进入瓶内的水超过瓶容积的1/5. ③从操作角度分析,产生误差的原因可能是(写一点) 止水夹未夹紧 止水夹未夹紧 . | ||||||||
| 用草酸钠(Na2C2O4)分解产生的CO还原CuO(铁架台略) |  |
①实验开始,应先点燃A处酒精灯,过一会再点燃B处酒精灯,这样操作的目的是 点燃A处酒精灯,使草酸钠分解生成了一氧化碳,排净试管内的空气,防止爆炸 点燃A处酒精灯,使草酸钠分解生成了一氧化碳,排净试管内的空气,防止爆炸 .②B处玻璃管内的现象是 黑色粉末变成红色 黑色粉末变成红色 ,发生反应的化学方程式为CuO+CO
CuO+CO .
③该装置有待改进之处是 应添加尾气处理装置 应添加尾气处理装置 . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 Ⅰ.通过一月的化学学习,你应该知道有多种途径可以制取氧气.如:
Ⅰ.通过一月的化学学习,你应该知道有多种途径可以制取氧气.如:
| ||
| 加热 |
| ||
| 加热 |
| 加热 |
| 加热 |
| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com