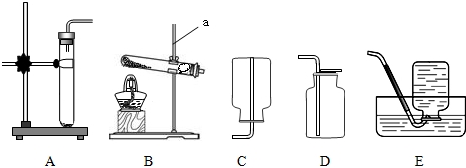
解:(1)根据常见仪器的特点可知:a为酒精灯;
(2)过氧化氢在二氧化锰的催化作用下制取氧气,反应的化学方程式为:2H
2O
2
2H
2O+O
2↑;若用高锰酸钾制取氧气,条件为加热应选择固固加热装置B;
(3)实验室常用大理石和稀盐酸制取二氧化碳,反应的化学方程式为CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑,应选用固液不加热装置A;二氧化碳能溶于水,密度比空气大,应用向上排空气法收集,所以选用装置D收集二氧化碳,将燃着的木条放在集气瓶口,若观察到木条熄灭,说明瓶中已充满二氧化碳;
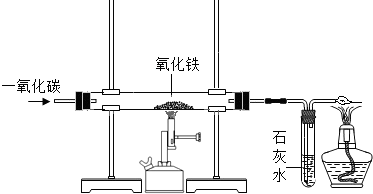
(4)炼铁的原理利用一氧化碳与氧化铁在高温下反应,生成铁和二氧化碳,实验中玻璃管内的粉末由红色变黑色;通过该实验的全部装置中的实验现象,证明一氧化碳能还原氧化铁,具有还原性,尾气必须处理是因有毒性,用点燃的方法处理尾气,还可以证明一氧化碳有可燃性,用化学方程式表示为2CO+O
2
2CO
2.
故答案为:(1)酒精灯;
(2)2H
2O
2
2H
2O+O
2↑;B;
(3)CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;D,木条熄灭;
(4)2CO+O
2
2CO
2.
分析:可根据反应物的状态及其反应条件选择发生装置,反应物为固体需要加热,则选择固体加热型发生装置,反应物为固体和液体,在常温下就能反应,则选择液固常温型发生装置,根据气体的密度和水溶性选择收集装置,难溶于水的气体能使用排水法收集,密度比空气大的气体能使用向上排空气法收集,密度比空气小的气体能使用向下排空气法收集;因CO与氧化铁反应生成铁粉,根据现象来回答在该反应中CO得到氧,被氧化,本身作还原剂,一氧化碳还具有可燃性.
点评:气体的制取是初中重要的化学实验之一,既是难重点,又是考查热点,理解反应原理,掌握装置的选择依据、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.

 2H2O+O2↑;若用高锰酸钾制取氧气,条件为加热应选择固固加热装置B;
2H2O+O2↑;若用高锰酸钾制取氧气,条件为加热应选择固固加热装置B; 2CO2.
2CO2. 2H2O+O2↑;B;
2H2O+O2↑;B; 2CO2.
2CO2.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案