


科目:初中化学 来源: 题型:
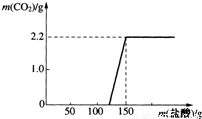
 (2006?常德)实验室现有一瓶已使用过的氢氧化钠溶液,某小组同学就“该溶液是否变质”对其进行了探究.请你参与探究:
(2006?常德)实验室现有一瓶已使用过的氢氧化钠溶液,某小组同学就“该溶液是否变质”对其进行了探究.请你参与探究:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
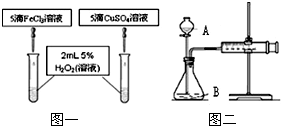
 在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.
在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.| 催化剂及用量 | O2 平均产量 | 制氧所需时间 | 成本 | 反应情况 |
| MnO21.0g | 919mL | 10′03″ | 0.11元 | 分解先快后慢 |
| 10%FeCl3溶液5滴 | 985mL | 4′50″ | 0.02元 | 均匀产生O2 |
| 15%CuSO4溶液5滴 | 955mL | 4′57″ | 0.03元 | 均匀产生O2 |
| ||
| ||
| 浓度 时间(min) 条件 |
30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
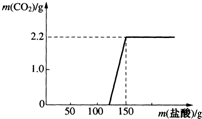 实验室现有一瓶已使用过的氢氧化钠溶液,某小组同学就“该溶液是否变质”对其进行了探究.请你参与探究:
实验室现有一瓶已使用过的氢氧化钠溶液,某小组同学就“该溶液是否变质”对其进行了探究.请你参与探究:查看答案和解析>>
科目:初中化学 来源:2013年黑龙江省哈尔滨市中考化学模拟试卷(五)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com