
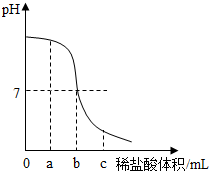
 向烧杯中加入20g 1.2%的氢氧化钠溶液,再慢慢滴入1.0%的稀盐酸,并用玻璃棒不断搅拌.实验过程中,用pH试纸多次测定溶液pH,溶液的pH随加入盐酸的体积变化的情况如图所示.请回答下列问题.
向烧杯中加入20g 1.2%的氢氧化钠溶液,再慢慢滴入1.0%的稀盐酸,并用玻璃棒不断搅拌.实验过程中,用pH试纸多次测定溶液pH,溶液的pH随加入盐酸的体积变化的情况如图所示.请回答下列问题.分析 (1)根据pH试纸使用方法分析判断;
(2)根据溶液pH的变化图象的意义,分析溶液中的阴离子;
(3)由盐酸的体积和密度可求出盐酸的质量.
解答 解:
(1)用pH试纸测定溶液pH的操作是将pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上,然后和比色卡比较;
(2)氢氧化钠溶液和稀盐酸反应的化学方程式为:NaOH+HCl═NaCl+H2O;
由溶液pH的变化图象可知,在a点时,溶液的pH大于7,溶液呈碱性,说明了氢氧化钠与盐酸反应生成了氯化钠,溶液中还有剩余的氢氧化钠.所以溶液中的阴离子是:Cl-、OH-;在C点时,溶液呈酸性,氢氧化钠全部与盐酸反应生成了氯化钠,溶液中还有剩余的盐酸,向所得的溶液中加入酚酞溶液,溶液呈无色;
(3)由溶液pH的变化图象可知,在a点时,溶液的pH等于7,说明了氢氧化钠和盐酸恰好中和;氢氧化钠的质量=20g×1.2%=0.24g
设稀盐酸中溶质质量为x
NaOH+HCl═NaCl+H2O
40 36.5
0.24g x
$\frac{40}{0.24g}=\frac{36.5}{x}$
x=0.219g
稀盐酸的质量=$\frac{0.219g}{1%}$=21.9g
根据稀盐酸的密度为1.0g/cm3,则稀盐酸的体积为$\frac{21.9g}{1g/c{m}^{3}}$=21.9cm3,和21.9mL
答案:
(1)将pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上,然后和比色卡比较
(2)NaOH+HCl═NaCl+H2O Cl-、OH- 无
(3)21.9
点评 本题是考查中和反应过程中溶液pH的变化情况的,我们要知道向酸中加碱和向碱中加酸时,溶液pH的变化趋向.明确不同指示剂的变色范围.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单质 | B. | 氧化物 | C. | 酸 | D. | 有机化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 合金是重要的金属材料.
合金是重要的金属材料.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
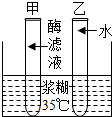 (1)为了探究酶的催化化作用,小王同学设计了如下的实验:取甲、乙两支洁净的试管,分别注入3毫升淀粉溶液,然后,在甲试管中注入2毫升新鲜的小麦淀粉酶滤液,在乙试管中注入2毫升清水,振荡两支试管.在接下来的下面三步操作中正确的顺序是②③①.
(1)为了探究酶的催化化作用,小王同学设计了如下的实验:取甲、乙两支洁净的试管,分别注入3毫升淀粉溶液,然后,在甲试管中注入2毫升新鲜的小麦淀粉酶滤液,在乙试管中注入2毫升清水,振荡两支试管.在接下来的下面三步操作中正确的顺序是②③①.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 食醋是厨房中的一种调味品,其中含有少量醋酸.下列有关醋酸的说法不正确的是( )
食醋是厨房中的一种调味品,其中含有少量醋酸.下列有关醋酸的说法不正确的是( )| A. | 醋酸分子是由碳、氢、氧三种原子构成的 | |
| B. | 醋酸中碳元素的质量分数为40% | |
| C. | 醋酸是由碳、氢、氧三种元素组成的 | |
| D. | 每个醋酸分子中有8个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com