实验室里有一瓶标签残缺的盐酸,请你参与下列有关问题的研讨.
(1)怎样立即确定该瓶盐酸是浓盐酸?有人猜测是,有人记得好象不是,大家各抒已见,你认为,应该用下列中的方法;(填编号)
A、讨论 B、调查 C、实验 D、上网
具体做法是.
(2)某同学想粗略测定该盐酸每亳升中含溶质HCl的质量,他依据酸和碱中和反应的原理,设计了一种实验方案,其操作步骤如下:
第一步,在小烧杯中加入10g5%的NaOH溶液; 第二步,向上述烧杯中滴入2滴酚酞试液;
第三步,向10mL的量筒里注入该盐酸至一定刻度;
条四步,用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,滴到溶液由红色刚刚变为无色为止,将胶头滴管中的剩余液体全部滴入量筒中;
第五步,记录实验数据;
第六步,计算确定每毫升盐酸中含溶质HCl的质量.
请根据以上实验过程,回答下列问题:
①本实验为什么要用指示剂(酚酞)?答:;
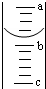
②第三步中向量筒注入盐酸,量筒中液面的位置如图所示,a与b、b与c刻度间均相差1mL,如果刻度a为4,量筒中盐酸的体积是;
③第四步要用到玻璃棒,它的用途是,目的是;
④第五步要记录的数据是;
(3)实验结束后有的同学认为,在(2)中测定每毫升盐酸中含溶质HCl的质量的原理和方法还有多种.请你利用所学的化学知识再写出几种其他方案(用文字简述所依据的原理和要测定的数据,不需要写化学方程式).
方法一:;
方法二:;
方法三:.




 应用题作业本系列答案
应用题作业本系列答案
 实验室里有一瓶标签残缺的盐酸,请你来探究:
实验室里有一瓶标签残缺的盐酸,请你来探究: