

分析 (1)根据饱和溶液的判断方法来分析;
(2)根据t1℃时两物质的溶解度大小来分析;根据物质溶解度受温度的影响来分析;
(3)据物质的溶解度随温度变化情况分析提纯物质的方法.
解答 解:(1)由题干可知,充分搅拌后A烧杯中还有不溶解的晶体存在,所以该烧杯中的溶液一定是饱和的,B中加入25g乙物质,搅拌后完全溶解,此溶液可能是不饱和的,也可能恰好是饱和状态,而同样多的水中,加入15g乙物质所得溶液一定是不饱和的,故填:C;
(2)有题干信息可知,t1℃时,乙物质的溶解度大于甲物质的溶解度,所以曲线x表示甲物质;若将温度从t2℃降到t1℃时,A烧杯中的甲物质仍不能完全溶解,此时的溶液仍为该温度下的饱和溶液;故填:部分;饱和;
(3)A的溶解度随温度的升高变化大,B的溶解度受温度影响不大,所以若甲物质中混有少量的乙物质,若要分离A、B两种物质,采用的最好方法是降温结晶.故填:降温结晶.
点评 本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.


科目:初中化学 来源: 题型:选择题
| 物质 | a | b | c | d |
| 反应前的质量/g | 30 | 20 | 10 | 15 |
| 反应后的质量/g | X | y | 0 | 10 |
| A. | 参加反应的c与d的质量比为2:1 | B. | x的取值范围:0≤x≤30 | ||
| C. | 当y≤20时,该反应一定是化合反应 | D. | x+y=65 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
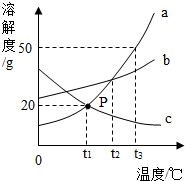 如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空:
如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com