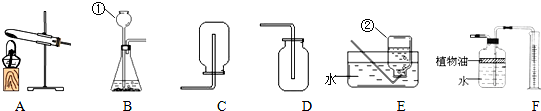
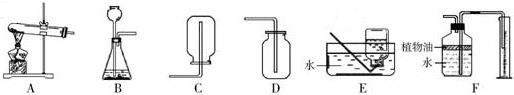
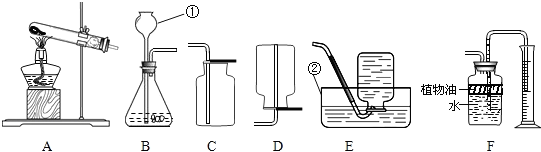
解答:解:AB应属于发生装置,其余的是收集装置.装置A适于固体加热的反应,而装置B适于固液不需要加热的反应,c适于密度大于空气的气体收集装置,D适于密度小于空气的气体收集,E适于难溶于水的气体的收集,F适于能溶于水的气体的收集;
(1)①②是实验室制取气体时常用的仪器长颈漏斗和水槽;
(2)装置B适于固液不需要加热的反应,故实验室用石灰石与稀盐酸反应制取二氧化碳,应选用的发生装置是B,二氧化碳密度大于空气密度,故收集装置应选择C.
该反应的文字表达式是:碳酸钙+盐酸→氯化钙+二氧化碳+水;
(3)实验室制取二氧化碳常用石灰石和稀盐酸反应,而F中的植物油就起到避免二氧化碳和水反应的可能,影响实验的准确性;植物油上方原有的空气对实验的结果没有影响.
(4)装置A适于固体加热的反应,故实验室用高锰酸钾(KMnO
4)制取氧气可选择A;氧气密度大于空气,不易溶于水就,故收集装置可选择C或E,高锰酸钾在加热条件下反应生成锰酸钾、二氧化锰和氧气,该反应的文字表达式为:高锰酸钾
锰酸钾+二氧化锰+氧气;该反应符合一变多的特点,故属于分解反应;
(5)根据质量守恒定律,化学反应前后元素的种类不变,故猜想的理由是它们都是含有氧元素的化合物;
第一组同学取一定质量的MnO
2,在250℃条件下加热一段时间,冷却后测得MnO
2的质量不变,则说明二氧化锰没有分解,故猜想1错误;
第二组同学取K
2MnO
4在250℃条件下加热,没有用测定质量的方法,也得出了猜想Ⅱ正确的结论,该组同学选择的实验方法是制的了一些氧气;
要想验证K
2MnO
4受热只能部分分解,可能是生成物氧化钾(K
2O)对其分解产生影响,可以设计对照实验,即取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾,用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
故答案为:(1)长颈漏斗,水槽 (2)B,C,碳酸钙+盐酸→氯化钙+二氧化碳+水;(3)防止二氧化碳溶于水,与水反应,没有
(4)A,C或E,高锰酸钾
锰酸钾+二氧化锰+氧气,分解反应、
(5)【提出猜想】它们都是含有氧元素的化合物 ( 或:含有氧元素的物质)
【实验验证】1,制得了一些氧气
【拓展延伸】取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾,用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.



 导学教程高中新课标系列答案
导学教程高中新课标系列答案