
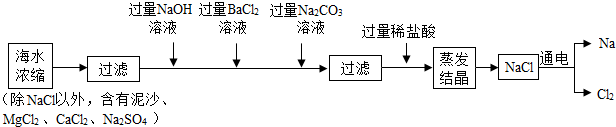
分析 (1)根据过滤、蒸发结晶的原理分析;
(2)根据碳酸钠能与氯化钡、氯化钙反应分析加入Na2CO3溶液目的,写出有关的方程式;硫酸能与碳酸钠反应生成了硫酸钠引入了杂质.
(3)根据铁与硫酸铜的反应和冶炼金属的条件分析回答有关的问题.
解答 解:(1)过滤是将难溶性固体与液体分离的一中实验操作.在上述蒸发结晶的过程中没有新物质生成,发生了物理 变化.
(2)由于碳酸钠能与氯化钡、氯化钙反应,所以加入过量Na2CO3溶液目的是除去CaCl2和氯化钡;由于硫酸能与碳酸钠反应生成了硫酸钠,硫酸不易挥发,所以在流程中不能用过量稀硫酸代替过量稀盐酸的原因是:引入了杂质硫酸钠和硫酸,Na2CO3与CaCl2反应的化学方程式是:Na2CO3+CaCl2=CaCO3↓+2NaCl.
(3)我国古代湿法炼铜是将铁放入硫酸铜溶液中,由于铁的金属活动性比铜强,与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.依据炼铜与炼钠的反应条件不同可知,金属钠的制取需要通电熔融,比铜获得更晚.
故答为:(1)液体,物理.
(2)氯化钡,硫酸钠和硫酸,Na2CO3+CaCl2=CaCO3↓+2NaCl.
(3)Fe+CuSO4═FeSO4+Cu,更晚.
点评 本题主要考查了化学实验的基本操作和物质的分离提纯,熟悉酸碱盐的知识是解答本题的关键.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:初中化学 来源: 题型:解答题
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 25 | 25 | 50 |
| 所用稀硫酸的质量/g | 120 | 160 | 100 |
| 生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 铬是重要的合金元素,镀在金属上可以防锈,元素周期表中“铬”的信息如图所示,下列关于铬元素说法正确的是( )
铬是重要的合金元素,镀在金属上可以防锈,元素周期表中“铬”的信息如图所示,下列关于铬元素说法正确的是( )| A. | 是非金属元素 | B. | 原子序数为24 | ||
| C. | 相对原子质量为52.00g | D. | 中子数为24 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 溶液中一定没有银离子 | B. | 滤渣中一定含有金属单质M | ||
| C. | 滤渣中可能含有单质铜 | D. | 加入的金属M可能是单质锌 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图所示A--F是初中化学常见的物质.图中“→”表示转化关系,“-“表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.
如图所示A--F是初中化学常见的物质.图中“→”表示转化关系,“-“表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀硫酸的质量/g | 50g | 50g | 50g | 50g |
| 剩余固体的质量/g | 43.5g | 37.0g | 30.5g | 30.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com