
 ×100%=
×100%=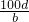 %;
%;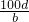 %;
%;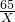 =
=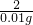
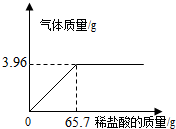
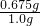 ×100%=67.5%
×100%=67.5% 

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:初中化学 来源: 题型:
| 实验次数 | 1 | 2 | 3 |
| 所取黄铜样品的质量/g | 10.0 | 10.0 | 20.0 |
| 加入稀硫酸的质量/g | 100.0 | 80.0 | 80.0 |
| 反应后烧杯内剩余物质的质量/g | 109.8 | 89.8 | 99.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| d g |
| b g |
| d g |
| b g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
为了测定铜锌合金粉末中铜的质量分数,某兴趣小组的同学设计了不同的方案进行实验:
甲同学的实验方案
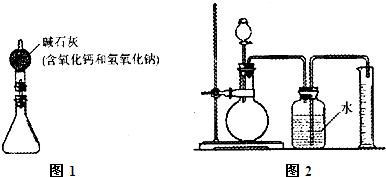
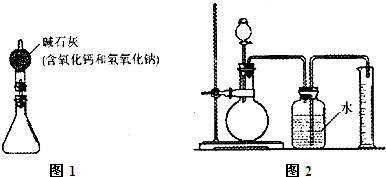
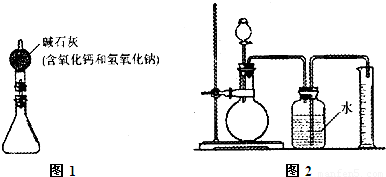
①按图5组装好装置,并称得装置的质量为a g。
②取下锥形瓶上的橡皮塞,向锥形瓶中加入b g铜锌合金粉末,再加入足量的稀盐酸,立即塞紧橡皮塞。
③待充分反应后,称得装置和装置中物质的总质量为c g。
④计算铜锌合金中铜的质量分数。
乙同学的实验方案
①按图6组装好装置。
②取下烧瓶上的橡皮塞,向锥形瓶中加入1.0 g铜锌合金粉末,塞紧橡皮塞。
③通过分液漏斗向烧瓶中加入10.0 mL稀硫酸(足量),立即关闭分液漏斗活塞。
④待充分反应后,测得进入量筒的水的体积为122.0 mL。
⑤计算铜锌合金中铜的质量分数。
回答下列问题:
(1)锥形瓶中发生的反应属于__________ (填基本反应类型)。图5装置中碱石灰的作用是____________________。
(2)甲同学若要计算出样品中铜的质量分数,还需要测得的数据是__________。(填标号)
A.碱石灰的质量 B.加入的稀盐酸的质量 C.稀盐酸中溶质的质量分数
(3)在甲同学实验后,丙同学过滤锥形瓶中的物质,洗涤、干燥滤渣,称得滤渣质量为d g。
丙同学测得铜锌合金中铜的质量分数为__________。
(4)为减少实验误差,在乙同学的实验步骤①和②之间还需要增加的实验操作是——,这样能保证实验称量结果的准确性。已知该温度下氢气的密度为
0.09g/L,则乙同学测得的铜锌合金中铜的质量分数为__________。


查看答案和解析>>
科目:初中化学 来源:2012年福建省福州市初中学业质量检查化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com