


分析 (1)根据钢铁锈蚀的影响要素分析;
(3)根据除杂的原则分析,计算中应该抓住物质的量的关系进行,确定水、二氧化碳和氧化铁的质量,进而确定化学式;
(4)根据图确定对应的氧化铁失去氧的情况,进而确定生成的铁的化合物的化学式,最后书写化学方程式;
(5)根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸亚铁的质量,进而求算对应的质量分数
解答 解:
(1)A铁钉同时接触到氧气和水,所以容易生锈;
B铁钉接触到水,但是没接触到氧气,所以很难生锈;
C铁钉接触到氧气和水的同时,由于氯化钠的存在,加速了生锈,导致最先观察到铁锈.
故选:C.
(3)铁锈组分的确定
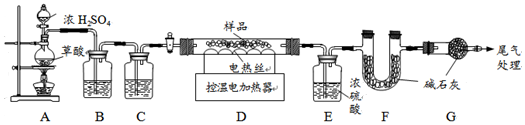
某铁锈成分为Fe2O3•xH2O和FeCO3.为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用如图装置进行实验.
【查阅资料】Fe2O3•xH2O失去水分子温度为110℃,FeCO3在282℃分解为FeO和CO2.温度高于400℃时铁的氧化物才能被CO还原.
①装置A中的反应为:H2C2O4(草酸)$→_{△}^{浓硫酸}$CO↑+CO2↑+H2O.通过B、C装置可得到干燥、纯净的CO气体,在有水和二氧化碳的情况下要得到干燥、纯净的一氧化碳,应该先除二氧化碳后除水蒸气,所以洗气瓶B中最好盛放氢氧化钠溶液,因为氢氧化钠的溶解度大于氢氧化钙,这样吸收二氧化碳的能力更强.C装置装有浓硫酸,去除一氧化碳中混有的水蒸气.
②现控制D装置中的温度为300℃对铁锈进行热分解,所以此时只有Fe2O3•xH2O的失水和FeCO3分解为FeO和CO2直而没有铁的氧化铁和一氧化碳的反应,也可以说此时一氧化碳没有参与反应,则生成的二氧化碳与一氧化碳无关.冷却后装置E增重3.6g这是Fe2O3•xH2O的失去的水的质量,装置F增重2.2g,是碳酸亚铁分解生成的二氧化碳的质量.
设碳酸亚铁的质量为x
FeCO3$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑
116 44
x 2.2g
$\frac{116}{44}$=$\frac{x}{2.2g}$
x=5.8g
则Fe2O3•xH2O中Fe2O3的质量为25.4g-5.8g-3.6g=16g
则Fe2O3•xH2O中Fe2O3和H2O分子个数比为$\frac{16g}{160}$:$\frac{3.6g}{18}$=1:2,所以x=2
(4)固体质量由48.0g变为46.4g时,对应温度为400-500℃,此时Fe2O3与CO反应,根据氧化性Fe2O3>Fe3O4>FeO可知,与CO发生反应时.失去氧48g-46.4=1.6g
氧化铁中氧元素为48.0g×$\frac{48}{56×2+16×3}$×100%=14.4g,铁元素质量=48-14.4g=33.6g
残余固体中氧元素质量=14.4g-1.6g=12.8g
铁氧原子个数比=$\frac{33.6g}{56}$:$\frac{12.8g}{16}$=3:4,所以此时还原产物为Fe3O4
对应方程式3Fe2O3 +CO$\frac{\underline{\;400℃~500℃\;}}{\;}$2Fe3O4+CO2;
(5)根据质量守恒定律可得,生成的二氧化碳的质量为10g+200g-207.8g=2.2g
设碳酸亚铁的质量为x
FeCO3+H2SO4═FeSO4+H2O+CO2↑
116 44
x 2.2g
$\frac{116}{44}$=$\frac{x}{2.2g}$
x=5.8g
该样品中FeCO3的质量分数为$\frac{5.8g}{10g}$×100%=58%.
故填:
(1)C;
(3)①C;
②5.8; 2.
(4)3Fe2O3 +CO$\frac{\underline{\;400℃~500℃\;}}{\;}$2Fe3O4+CO2.
(5)58%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:初中化学 来源: 题型:选择题

| A. | 过程1是化学变化,过程2是物理变化 | |
| B. | 甲是混合物,乙和丙都是纯净物 | |
| C. | 引起过程2的原因可能是温度降低 | |
| D. | 上述变化中的反应一定是吸热反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 共享单车的出现,方便了市民出行,减少了机动车尾气的污染.
共享单车的出现,方便了市民出行,减少了机动车尾气的污染.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 后母戊鼎(原称司母戊鼎),原器1939年3月在河南安阳出土,是商王祖庚或祖甲
后母戊鼎(原称司母戊鼎),原器1939年3月在河南安阳出土,是商王祖庚或祖甲查看答案和解析>>
科目:初中化学 来源: 题型:选择题
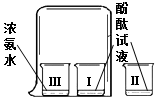
| A. | 氨水显碱性 | |
| B. | Ⅰ烧杯中酚酞变红,说明分子不断运动 | |
| C. | Ⅰ烧杯中酚酞试液变红,Ⅲ烧杯中浓氨水没有变色 | |
| D. | 温度越高,分子运动越快 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
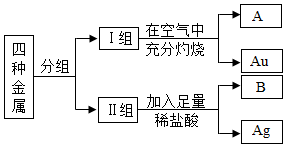 某课外活动小组的同学在老师的帮助下从废弃家电中获得了铁(Fe)、铜(Cu)、银(Ag)、金(Au)四种金属.如何区分这四种金属呢?同学们进行如下实验:
某课外活动小组的同学在老师的帮助下从废弃家电中获得了铁(Fe)、铜(Cu)、银(Ag)、金(Au)四种金属.如何区分这四种金属呢?同学们进行如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com