
| 装置C的质量 | 装置D的质量 | |
| 步骤③ | 292.4g | 198.2g |
| 步骤⑥ | 296.9g | 207.0g |
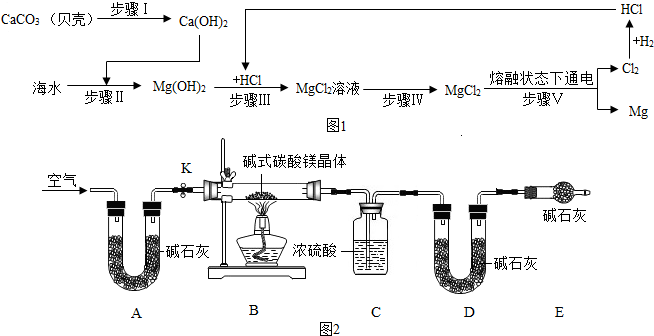
分析 (1)步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁,其中牵扯的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+H2O=Ca(OH)2;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2═MgCl2+2H2O;化合反应的特点“多变一”;分解反应的特点“一变多”;复分解反应的特点是两种化合物相互交换成分,生成另外两种化合物;置换反应的特点是单质和化合物生成单质和化合物,由此可知该过程无置换反应;
(2)(2)①根据A、D装置的药品及作用解答;
②根据碱式碳酸镁晶体受热分解的产物和生成水和二氧化碳的质量解答;
③根据生成水的质量为:4.66g-3.94g=0.72g,碱式碳酸镁的相对分子质量为:84x+58y+18z,以及镁、碳、氢元素的质量进行解答.
解答 解:(1)①A、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+H2O=Ca(OH)2步骤Ⅰ通过两步反应即可实现;
B、步骤Ⅱ、Ⅲ可得到氢氧化镁沉淀,步骤Ⅳ加入盐酸,可得到氯化镁,故B正确;
C、步骤Ⅴ中化学能转化为电能,说法错误,应为电能转化为化学能;
D、在此流程中涉及的基本反应类型有3种,无置换反应.
故选B.
②生成的氯化氢气体溶于水形成盐酸还可以和氢氧化镁反应,所以在此流程中可以循环利用的物质是氯化氢;故填:将氯化氢循环利用.
(2)①碱石灰的作用是除去空气中的二氧化碳和水;D的作用是吸收反应生成的二氧化碳;故填除去空气中的二氧化碳和水;吸收反应生成的二氧化碳
②碱式碳酸镁晶体受热分解生成氧化镁、二氧化碳和水,反应生成水的质量296.9g-2924g=4.5g;生成二氧化碳的质量207.0g-198.2g=8.8g;
所以生产氧化镁的质量=23.3g-4.5g-8.8g=10g.故填氧化镁;10g
③镁元素的质量为:10g×$\frac{24}{40}$×100%=6g,
碳元素的质量为:8.8×$\frac{12}{44}$×100%=2.4g,
氢元素的质量为:4.5g$\frac{2}{18}$×100%=0.5g,
则有:
23.3g×$\frac{(x+y)×24}{84x+58y+18z}$×100%=6g,
23.3g×$\frac{12x}{84x+58y+18z}$×100%=2.4g,
23.3g×$\frac{2z}{84x+58y+18z}$×100%=0.5g,
解得:x=4,y=1,z=4,该碱式碳酸镁晶体[xMgCO3•yMg(OH)2•zH2O]中,x:y:z=4:1:4;故填4:1:4
点评 本考点属于盐的性质中实验方法和过程的探究,根据物质的化学性质,要认真分析,不仅要把握实验设计的每一个步骤中的实验目的,还要加强记忆除去常用离子的方法,从而突破难点.有关的计算要准确,本考点经常出现在实验题中.


科目:初中化学 来源: 题型:选择题
| A. | Fe3+SO42- H+Cl- | B. | Mg2+Cl- OH- Na+ | ||
| C. | H+SO42- K+CO32- | D. | Na+Ba2+NO3 SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铜丝插入硫酸铝溶液中,溶液由无色变为蓝色 | |
| B. | 氨气接触到湿润的红色石蕊试纸,试纸变蓝 | |
| C. | 硫在空气中燃烧,发出明亮的蓝紫色火焰,生成无色无味的气体 | |
| D. | 向铜绿中滴加稀盐酸,溶液变成黄色,产生有刺激性气味的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量反应后的溶液于试管中,滴加酚酞试液 | 溶液不变红色 | 猜想一不正确 |
| ②另取少量反应后的溶液于试管中,加入CaCO3 | 无气泡产生 | 猜想二不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com