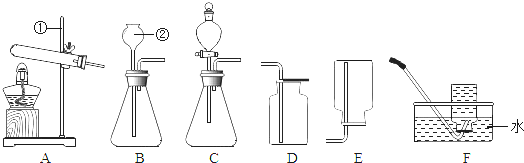
解答:解:(1)标号仪器分别是铁架台、长颈漏斗;故答案为:铁架台;长颈漏斗;
(2)实验室用加热氯酸钾和二氧化锰的混合物来制取氧气,属于固体加热型,故选发生装置A,氧气密度比空气大且不易溶于水,所以可用向上排空气法或排水法收集,反应方程式是2KClO
32KCl+3O
2↑;高锰酸钾加热产生锰酸钾、二氧化锰和氧气,反应的方程式为:2KMnO
4K
2MnO
4+MnO
2+O
2↑;检验氧气的方法为:将带火星的木条放在集气瓶内,木条复燃;若收集完氧气后,先熄灭酒精灯,再将导管从水槽中取出,易导致水倒流进试管,炸裂试管;由于试管中有空气,所以刚开始加热时空气受热膨胀从而逸出试管,此时若收集则会使收集到的气体不纯,当气泡连续并比较均匀地放出时为最佳收集时机;
故答案为:AD或AF;2KClO
32KCl+3O
2↑;2KMnO
4K
2MnO
4+MnO
2+O
2↑;将带火星的木条放在集气瓶内,木条复燃;防止水倒流引起试管炸裂;当气泡连续、均匀地冒出时;
(3)实验室利用大理石和稀盐酸反应制取二氧化碳,不需加热,可用此发生装置,二氧化碳的密度比空气大,可用向上排空气法收集,故BD组合可制取二氧化碳,选择发生装置B的原因是该反应的反应物是固体和液体,且反应不需加热;
故答案为:二氧化碳(合理即可);反应物是固体和液体,且反应不需加热;
(4)实验室通常用固体CaC
2与水反应制取气体乙炔(C
2H
2),且该反应非常剧烈,所以要制取纯净的乙炔气体,且安全、节约药品,可选择有分液漏斗的发生装置,因为分液漏斗可逐滴滴加液体,控制反应速率,操作安全,而乙炔难溶于水,所以收集纯净的乙炔可用排水法;
故答案为:CF;
(5)只能用向下排空气法收集的气体,说明其密度比空气小、易溶或能溶于水;
故答案为:密度比空气小、易(能)溶于水;
(6)试管口略向下倾斜的目的是防止冷凝的水倒流回试管底部引起试管炸裂;
故答案为:防止冷凝水倒流回试管底部引起试管炸裂;
(7)做木炭在氧气中燃烧的实验时,应该慢慢将木炭放到集气瓶的底部,如果太快会使气体引发对流,生成的二氧化碳与氧气混合,使现象不明显;
故答案为:防止氧气膨胀溢出,使实验现象不明显;
(8)若用排水法收集氧气,如果刚出现气泡就开始收集,收集前集气瓶中的水不满,都能够导致收集的氧气不纯;
故答案为:未等气泡均匀连续放出时就开始收集,集气瓶内未装满水等;
(9)C装置比B装置好的原因:可以控制滴加液体的速率,从而控制反应速率;
故答案为:可以控制滴加液体的速率,从而控制反应速率;
(10)反应物是固体,反应条件是加热,可以选择A装置作为发生装置;
故答案为:反应物是固体,反应条件是加热.




 ”“
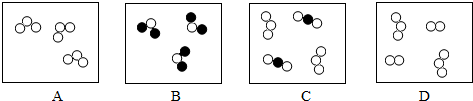
”“ ”表示两种不同的原子,则下列表示的气体物质中,属于化合物的是
”表示两种不同的原子,则下列表示的气体物质中,属于化合物的是