
| 物质质量 | 乙醇 | 氧气 | 二氧化碳 | 水 |
| 反应前/g | 4.6 | a | 0 | 0 |
| 反应后/g | 0 | 0 | 8.8 | 5.4 |
分析 (1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
(2)根据质量守恒定律和有关化学式的计算知识进行分析.
解答 解:(1)根据反应的化学方程式X+2NaOH═Na2SiO3+H2O,反应物中O、Na、H原子个数分别为2、2、2,反应后的生成物中Si、O、Na、H原子个数分别为1、4、2、2,根据反应前后原子种类、数目不变,则每个X分子由2个O原子和1个Si原子构成,则物质X的化学式为SiO2.
(2)①根据质量守恒定律可知,a=8.8+5.4-4.6=9.6;
②生成物中,二氧化碳中碳元素的质量为8.8g×$\frac{12}{44}$=2.4g,水中氢元素的质量为5.6g×$\frac{2}{18}$=0.6g;
③由于氧气只含氧元素,故生成物中的碳元素和氢元素都来自于反应物中的乙醇,2.4g+0.6g<4.6g,因此乙醇中一定含有氧元素,其质量为4.6g-2.4g-0.6g=1.6g,乙醇所含碳、氢、氧元素的质量比为2.4g:0.6g:1.6g=12:3:8,原子个数比为$\frac{12}{12}$:$\frac{3}{1}$:$\frac{8}{16}$=2:6:1.
故填:(1)SiO2;(2)①9.6;②2.4g;0.6g;③乙醇;含有;1.6g;12:3:8;2:6:1.
点评 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是解题的关键.


 字词句段篇系列答案
字词句段篇系列答案科目:初中化学 来源: 题型:解答题
 如图是X、Y、Z三种固体物质的溶解度曲线,请回答下列问题:
如图是X、Y、Z三种固体物质的溶解度曲线,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子大小可以改变 | B. | 分子由原子构成 | ||
| C. | 分子在不断运动 | D. | 分子可以保持物质的化学性质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子、原子可以构成物质,所以物质一定是由分子、原子构成的 | |
| B. | 碱性溶液能使酚酞试液变红色,所以能使酚酞试液变红色的溶液的pH一定大于7 | |
| C. | 溶液的特征是均一、稳定,所以均一、稳定的液体一定是溶液 | |
| D. | 稀有气体元素的原子最外层有8个(氦是2个)电子,所以微粒 一定是稀有气体元素的原子 一定是稀有气体元素的原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
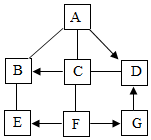 已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈 黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化 的关系如图所示(“-”表示两种物质间能发生反应,“→”表示两种物质间的转化 关系,部分反应物、生成物和反应条件已经略去).
已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈 黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化 的关系如图所示(“-”表示两种物质间能发生反应,“→”表示两种物质间的转化 关系,部分反应物、生成物和反应条件已经略去).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
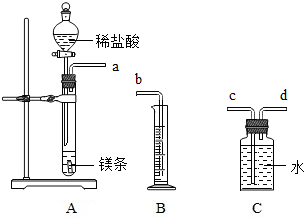
 利用如图所示实验装置制备常见气体,请回答有关问题
利用如图所示实验装置制备常见气体,请回答有关问题查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com