
分析 (1)由反应的化学方程式,找出KClO3→KCl→AgCl↓物质转化关系和质量比,由生成沉淀的质量,计算出参加反应的氯酸钾的质量,进而判断KClO3是否完全分解.
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,根据质量守恒定律,进行分析解答.
解答 解:(1)由反应的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑、KCl+AgNO3═AgCl↓+KNO3,则2KClO3~2KCl~2AgCl,即KClO3~KCl~AgCl,它们的质量关系为122.5:74.5:143.5.
设参加反应的氯酸钾的质量为x
KClO3~KCl~AgCl
122.5 143.5
x 5.74g
$\frac{122.5}{143.5}$=$\frac{x}{5.74g}$ x=4.9g
6g>4.9g,故KClO3没有完全分解.
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,通过称量加热后残留物质量,加热前后质量差,即为生成氧气的质量,由生成氧气的质量,由反应的化学方程式列式计算出参加反应的氯酸钾的质量,进而判断是否完全分解.
答:(1)KClO3~KCl~AgCl,质量比为122.5:74.5:143.5;KClO3没有完全分解;(2)赞同;由质量守恒定律,固体混合物减少的质量即为生成氧气的质量,由反应的化学方程式计算出参加反应的氯酸钾的质量.
点评 本题难度不大,掌握根据化学方程式的计算是正确解答本题的关键,解题时要注意解题的规范性.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:初中化学 来源: 题型:推断题
| 实验步骤 | 实验现象 |
| ①取一定量的合金粉末,加入过量的氢氧化钠溶液,充分反应后过滤,滤纸上剩余物备用 | 粉末部分溶解,并有无色体放出 |
| ②取步骤①所得固体物质,加入过量的稀硫酸,充分反应 | 固体物质部分溶解,并有无色气体放出,溶液呈浅绿色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生石灰用作干燥剂 | B. | 氧气用于医疗急救 | ||
| C. | 用洗洁精洗涤餐具上的油污 | D. | 熟石灰可用于改良酸性土壤 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
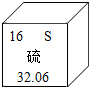 如图是元素周期表中某元素的相关信息,从图中不能直接获取的信息是( )
如图是元素周期表中某元素的相关信息,从图中不能直接获取的信息是( )| A. | 该元素属于非金属元素 | |
| B. | 该元素的原子序数为16 | |
| C. | 该元素的相对原子质量32.06 | |
| D. | 该元素组成的单质常温下是黄色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 未溶解固体的质量/g | 8.4 | 4 | 0 | 18.4 |
| A. | 所得四杯溶液都是饱和溶液 | |
| B. | 丁溶液的溶质质量分数最大 | |
| C. | 20℃时四种物质质溶解度的关系为:丁>甲>乙>丙 | |
| D. | 四杯溶液中各加入20℃的100g水后,溶液质量相等,且均为不饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
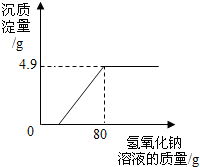 某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验:取废水300g,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图,请分析计算:
某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验:取废水300g,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图,请分析计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com