二甘醇的化学式为C4H10O3,它在人体内可发生如下反应:C4H10O3+4O2═2X+3H2O,而导致中毒.请填空
1个二甘醇的分子有______个原子.X的化学式______、______克C4H10O3与150克乙醇充分燃烧释放的二氧化碳等量.
【答案】
分析:根据标在元素符号右下角的数字表示一个分子中所含原子的个数;进行解答;根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,进行解答;根据碳元素的质量守恒结合化合物中元素的质量分数来计算二甘醇的质量.
解答:解:根据标在元素符号右下角的数字表示一个分子中所含原子的个数;可得一个“二甘醇”分子中共有原子数为:4+10+3=17;反应C
4H
10O
3+4O
2═2X+3H
2O,根据化学变化前后原子的种类和数目不变,反应前共含有C、H、O三种原子的原子个数依次为4个C、10个H、11个O;而反应后生成的3个H
2O分子中只含有6个H原子、3个O原子,则2个X分子中含4个C原子、4个H原子和8个O原子,则物质X的化学式可表示为C
2H
2O
4;
由于二甘醇和乙醇完全燃烧后其中的碳元素都转化为二氧化碳,根据碳元素的质量守恒可以计算出二甘醇的质量
设二甘醇的质量为x,则:
x?

×100%=150g×
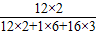
×100%
解得:x=51g
故答案为:17;C
2H
2O
4;51.
点评:本题考查学生对质量守恒定律及化学式意义的理解与掌握,并能在解题中灵活应用的能力.

 ×100%=150g×
×100%=150g×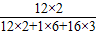 ×100%
×100%

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案